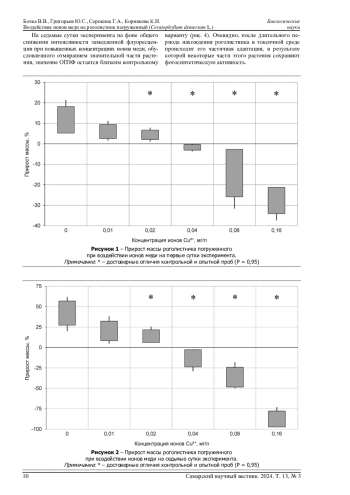
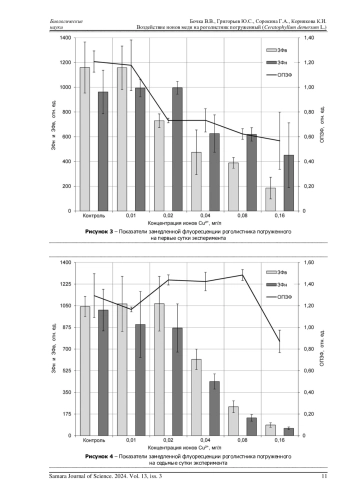
В данной статье представлены результаты исследования влияния ионов меди в концентрациях 0,01-0,16 мг/дм³ в лабораторных условиях на устойчивость высшего водного растения - роголистника погруженного. Несмотря на то, что медь является биофильным элементом, все изученные концентрации ионов данного элемента оказали негативное воздействие на прирост массы растений и величину относительного параметра замедленной флуоресценции хлорофилла (ОПЗФ) уже на первые сутки экспонирования. В течение семисуточного токсикологического эксперимента подавление роста растений при воздействии токсиканта усиливалось. Наибольшее снижение ОПЗФ по сравнению с контролем во всех исследованных концентрациях ионов меди наблюдается на первые сутки эксперимента. Однако после длительного периода нахождения роголистника в токсичной среде происходит его частичная адаптация, в результате которой некоторые части этого растения сохраняют фотосинтетическую активность. Установлено, что растения сохраняют свою жизнеспособность до концентрации 0,02 мг/дм³, соответствующей 20 ПДК в водах объектов рыбохозяйственного значения. Концентрации 0,04 мг/дм³ и выше уже на первые сутки привели к потере листьев. Устойчивость растения к действию ионов меди позволяет рассматривать его как потенциальный фиторемедиант вод, загрязненных соединениями данного элемента.
Идентификаторы и классификаторы
- SCI
- Биология
Загрязнение водной среды соединениями тяжелых металлов приводит к негативным последствиям для живых организмов, в том числе и для человека [1].
Список литературы
1. Галиулин Р.В., Галиулина Р.А., Кочуров Б.И. Аккумуляция тяжелых металлов водными растениями при техногенезе // Теоретическая и прикладная экология. 2013. № 2. С. 81-85. EDN: QZFFRB
2. Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам / отв. ред. Н.Н. Немова. Петрозаводск: Карельский научный центр РАН, 2007. 172 с. EDN: QKQKGB
3. Shabbir Z., Sardar A., Shabbir A., Abbas G., Shamshad S., Khalid S., Murtaza G., Dumat C., Shahid M. Copper uptake, essentiality, toxicity, detoxification and risk assessment in soil-plant environment // Chemosphere. 2020. Vol. 259. DOI: 10.1016/j.chemosphere.2020.127436 EDN: KRRDTV
4. Ali H., Khan E., Sajad M.A. Phytoremediation of heavy metals - concepts and applications // Chemosphere. 2013. Vol. 91, iss. 7. P. 869-881. DOI: 10.1016/j.chemosphere.2013.01.075
5. Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения [Электронный ресурс] // Гарант.ру. https://base.garant.ru/71586774.
6. Государственный доклад “О состоянии и охране окружающей среды в Красноярском крае в 2023 году”. Красноярск, 2024. 386 с.
7. Garcia L., Welchen E., Gonzalez D.H. Mitochondria and copper homeostasis in plants // Mitochondrion. 2014. Vol. 19, part B. P. 269-274. DOI: 10.1016/j.mito.2014.02.011
8. Printz B., Lutts S., Hausman J.-F., Sergeant K. Copper trafficking in plants and its implication on cell wall dynamics // Frontiers in Plant Science. 2016. Vol. 7. DOI: 10.3389/fpls.2016.00601
9. Thomas G., Stärk H.-J., Wellenreuther G., Dickinson B.C., Küpper H. Effects of nanomolar copper on water plants - comparison of biochemical and biophysical mechanisms of deficiency and sublethal toxicity under environmentally relevant conditions // Aquatic Toxicology. 2013. Vol. 140-141. P. 27-36. DOI: 10.1016/j.aquatox.2013.05.008
10. Constabel C.P., Barbehenn R. Defensive roles of polyphenol oxidase in plants // Induced Plant Resistance to Herbivory. Dordrecht: Springer, 2008. P. 253-270. DOI: 10.1007/978-1-4020-8182-8_12
11. Tavladoraki P., Cona A., Angelini R. Copper-containing amine oxidases and FAD-dependent polyamine oxidases are key players in plant tissue differentiation and organ development // Frontiers in Plant Science. 2016. Vol. 7. DOI: 10.3389/fpls.2016.00824 EDN: WOMELV
12. Krayem M., El Khatib S., Hassan Y., Deluchat V., Labrousse P. In search for potential biomarkers of copper stress in aquatic plants // Aquatic toxicology. 2021. Vol. 239. DOI: 10.1016/j.aquatox.2021.105952 EDN: CYTWUP
13. Волков К.С., Иванова Е.М., Великсар С.Г., Куликова А.Л., Кузнецова Н.А., Холодова В.П., Кузнецов В.В. Возможности использования растений различных семейств в целях фиторемедиации загрязненных медью территорий // Проблемы региональной экологии. 2013. № 1. С. 97-101. EDN: PZNIPX
14. Küpper H., Šetlík I., Spiller M., Küpper F.C., Prášil O. Heavy metal-induced inhibition of photosynthesis: targets of in vivo heavy metal chlorophyll formation // Journal of Phycology. 2002. Vol. 38, iss. 3. P. 429-441. DOI: 10.1046/j.1529-8817.2002.01148.x EDN: VQSMHB
15. Rehman A.U., Nazir S., Irshad R., Tahir K., Rehman K.U., Islam R.U., Wahab Z. Toxicity of heavy metals in plants and animals and their uptake by magnetic iron oxide nanoparticles // Journal of Molecular Liquids. 2021. Vol. 321. DOI: 10.1016/j.molliq.2020.114455 EDN: BJQLLJ
16. Rai S., Singh P.K., Mankotia S., Swain J., Satbhai S.B. Iron homeostasis in plants and its crosstalk with copper, zinc, and manganese // Plant Stress. 2021. Vol. 1. DOI: 10.1016/j.stress.2021.100008 EDN: CVRMZT
17. Thomas G., Andresen E., Mattusch J., Hubácek T., Küpper H. Deficiency and toxicity of nanomolar copper in low irradiance - a physiological and metalloproteomic study in the aquatic plant Ceratophyllum demersum // Aquatic Toxicology. 2016. Vol. 177. P. 226-236. DOI: 10.1016/j.aquatox.2016.05.016
18. Prasad M.N.V. Aquatic plants for phytotechnology // Environmental Bioremediation Technologies. Berlin-Heidelberg: Springer, 2007. P. 259-274. DOI: 10.1007/978-3-540-34793-4_11
19. Kafle A., Timilsina A., Gautam A., Adhikari K., Bhattarai A., Aryal N. Phytoremediation: mechanisms, plant selection and enhancement by natural and synthetic agents // Environmental Advances. 2022. Vol. 8. DOI: 10.1016/j.envadv.2022.100203 EDN: ROJLFP
20. Matache M.L., Marin C., Rozylowicz L., Tudorache A. Plants accumulating heavy metals in the Danube River wetlands // Journal of Environmental Health Science and Engineering. 2013. Vol. 11. DOI: 10.1186/2052-336x-11-39 EDN: YDQRHN
21. Parnian A., Chorom M., Jaafarzadeh N., Dinarvand M. Use of two aquatic macrophytes for the removal of heavy metals from synthetic medium // Ecohydrology & Hydrobiology. 2016. Vol. 16, iss. 3. P. 194-200. DOI: 10.1016/j.ecohyd.2016.07.001
22. Kastratović V., Krivokapić S., Bigović M., Đurović D., Blagojević N. Bioaccumulation and translocation of heavy metals by Ceratophyllum demersum from the Skadar Lake, Montenegro // Journal of the Serbian Chemical Society. 2014. Vol. 79, iss. 11. P. 1445-1460. DOI: 10.2298/jsc140409074k
23. Chorom M., Parnian A., Jaafarzadeh N. Nickel removal by the aquatic plant (Ceratophyllum demersum L.) // International Journal of Environmental Science and Development. 2012. Vol. 3, № 4. P. 372-375. DOI: 10.7763/ijesd.2012.v3.250
24. Губанов И.А., Киселева К.В., Новиков В.С., Тихомиров В.Н. Иллюстрированный определитель растений Средней России. Т. 1. Папоротники, хвощи, плауны, голосеменные, покрытосеменные (однодольные). М.: Т-во научных изданий КМК, Ин-т технологических исследований, 2002. 526 с.
25. Григорьев Ю.С., Стравинскене Е.С. Методика определения токсичности питьевых, природных и сточных вод, водных вытяжек из почв, осадков сточных вод и отходов по изменению относительного показателя замедленной флуоресценции культуры водоросли хлорелла (Chlorella vulgaris Beijer). ПНД Ф Т 14.1:2:4.16-2009. Т 16.1:2.3:3.14-2009. М.: Федеральный центр анализа и оценки техногенного воздействия, 2012. 43 с. EDN: ZRGEYN
26. Qadri H., Uqab B., Javeed O., Dar G.H., Bhat R.A. Ceratophyllum demersum - an accretion biotool for heavy metal remediation // Science of the Total Environment. 2022. Vol. 806, part 2. DOI: 10.1016/j.scitotenv.2021.150548 EDN: AIHADA
27. Титов А.Ф., Казнина Н.М., Таланова В.В. Тяжелые металлы и растения. Петрозаводск: Карельский научный центр РАН, 2014. 194 с. EDN: UAJSQV
Выпуск
Другие статьи выпуска
В статье анализируются рекомендованные Министерством науки и высшего образования прототипы рабочих программ обучающих модулей «Введение в информационные технологии» и «Информационные технологии и программирование», а также исследования в области цифровой грамотности россиян. Научная новизна состоит в разработке содержания модуля «Введение в информационные технологии», отвечающего целям по внедрению технологий искусственного интеллекта, декларируемых для всех образовательных организаций Российской Федерации. В результате разработана рабочая программа авторского модуля «Введение в информационные технологии», включающая в себя две дисциплины: «Цифровые технологии самообразования» и «Информатика». Деление связано с различием целей указанных дисциплин: первая изучает инструменты обучения, в том числе самостоятельного, вторая охватывает общие цифровые компетенции. Актуализация дисциплины «Информатика» состоит, в первую очередь, во включении блока, отвечающего за компетенцию в сфере создания цифрового контента, и замены блока изучения языков Pascal и СИ на основы языка программирования Python, что позволяет решить еще одну задачу, поставленную Министерством науки и высшего образования РФ, а именно: заложить базу для изучения модуля «Системы искусственного интеллекта», который становится обязательным для всех специальностей и направлений подготовки. Формируемый образовательный модуль предназначен, в первую очередь, для студентов образовательных программ бакалавриата и специалитета, направленных на подготовку кадров для транспорта и отнесенных к укрупненной группе специальностей и направлений подготовки 23.00.00 - Техника и технологии наземного транспорта. Результаты исследования могут быть интересны для методистов и научно-педагогических работников, ведущих активную работу по формированию образовательных модулей в области IT-технологий и искусственного интеллекта.
В условиях быстрого развития науки, технологий, профессиональной сферы требования к специалистам высшей квалификации постоянно возрастают. В современном образовательном пространстве профессионально-личностное развитие аспирантов стало важной темой для обсуждения в различных научных отраслях, особенно в контексте полипарадигмальности их педагогического сопровождения. Цель статьи: проанализировать ключевые аспекты вариативности в профессионально-личностном развитии аспирантов и определить подходы к их педагогическому сопровождению, учитывающие многообразие современных образовательных парадигм. В статье рассматриваются ключевые аспекты полипарадигмальности в педагогике высшей школы; роль и значение полипарадигмального подхода в педагогическом сопровождении профессионально-личностного развития аспирантов, а также его влияние на их профессиональный и личностный рост; представлена концепция полипарадигмального педагогического сопровождения, которое, опираясь на ключевые идеи различных парадигм (парадигмы субъектности, парадигмы социального научения и моделирование поведения; парадигмы метапознания; когнитивно-поведенческой парадигмы, гуманистической парадигмы, коннективистской парадигмы; информационно-цифровой парадигмы; личностно ориентированной парадигмы, конструктивистской парадигмы, компетентностной парадигмы, и др.), может предложить многообразие подходов, стратегий, методов, технологий для вариативной педподдержки аспирантов в их профессиональной социализации. В завершении статьи делается вывод: полипарадигмальное педсопровождение профессионально-личностного развития аспирантов должно отражать объективно-обусловленный, целесообразный синтез различных парадигм, обеспечивая комплексный подход к персонально-индивидуальному развитию обучающихся.
На сегодняшний день можно с уверенностью сказать, что общество пришло к пониманию критичной важности патриотического воспитания личности на самых разных уровнях. Особое внимание в этой проблеме уделяется задачам, стоящим перед учителями, школой и системой образования в целом. Основным источником патриотических качеств является история России. Любовь к Родине, родному краю, чувство гордости за своих соотечественников прошлого и настоящего, помимо общероссийского характера, тесно связаны с местом нашего рождения и жизни там, где начинается наш ученический и трудовой путь. История родного края позволяет сделать исторические представления менее абстрактными: показывает ученику, что история творится непосредственно здесь и что не только предыдущие поколения, но и мы вносим вклад в развитие нашего государства. Из истории субъектов нашей страны складывается общероссийская история, что также является значимым для понимания в процессе развития личности. Изучение истории родного края способно сформировать это понимание, а значит, и личность, готовую к созиданию, заботе и улучшению сложившихся основ жизни нашего общества. Актуальность изучения истории родного края продиктована последствиями глобализации, которые заключаются в угасании связей между поколениями родных, забвении традиций и духовных ценностей народов.
В статье анализируются и систематизируются изменения в методах преподавания вокального искусства в контексте современного музыкального образования в Китае. Музыкальное искусство Китая в настоящее время вызывает интерес публики и различных специалистов. С начала XX в. в программы обучения вокалистов активно внедряются техники и приемы различных западных музыкальных школ. В рамках работы рассмотрено, как классы по вокалу адаптируются к современным художественным направлениям и тенденциям. Кроме того, будет уделено внимание инновациям и экспериментам в обучении, которые компенсируют традиционные подходы, позволяя студентам развивать уникальную художественную индивидуальность. Цель работы - определение ключевых факторов, влияющих на современные методики обучения вокалу в высших учебных заведениях Китая, с учетом мировых трендов в области искусства и образования. Для достижения цели изучены работы различных китайских и русских специалистов в области музыкального искусства и вокала. Изучение теоретического материала, опыта преподавания, программ обучения в современных вузах позволило сделать выводы о том, что современная вокальная школа использует множество приемов, методов и инструментов. Процесс вокального образования прошел длинный путь эволюции, в котором традиционные подходы успешно сочетаются с инновационными практиками. Современные преподаватели активно используют инновационные методики, современные технологии, отслеживают и внедряют различные иностранные методологии.
В статье рассматриваются научные взгляды российских исследователей на опережающее профессиональное образование как предпосылку проектирования отраслевой профессиональной подготовки специалистов для создаваемой технологической платформы новой атомной энергетики. Изучение и систематизация теоретических и прикладных источников позволяет установить значимые концептуальные положения, существенные для разработки проекта опережающей подготовки специалистов, а именно научно-исследовательский потенциал образовательной среды опережающей профессиональной подготовки; личностный потенциал специалиста в единстве сторон «преобразующего интеллекта»; педагогическая система, объединяющая элементы процесса профессиональной подготовки (программы, технологии, принципы, цели-результаты). Анализ российских публикаций показывает неоднозначность понимания исследователями источника, создающего «импульс опережения» в профессиональном образовании: в постсоветский период особое внимание уделялось формированию личности специалиста, его профессиональным компетенциям и универсальным ресурсам. В условиях цифровой трансформации, не умаляя роли личности специалиста, акцент смещается в сторону технократического подхода, совершенствования инструментальной основы профессиональной подготовки (форсайт-прогнозы, гибкий контент, динамичный трансфер результатов науки в программы обучения, короткие программы для вариативной части основных программ). В статье подчеркивается целесообразность исследования опережающего профессионального образования в условиях цифровой трансформации системы образования на региональном и отраслевом уровнях. Статья отражает особенности проектирования опережающей профессиональной подготовки атомщиков ввиду специфики производства, высоких рисков и гарантий ядерной безопасности при динамичных темпах технологического обновления, что требует аккуратного согласования баланса фундаментальных инженерно-технических знаний и компетенций «проактивной» позиции специалиста в разработке образовательных технологий опережения.
Обоснована целесообразность обращения к фундаментальным закономерностям преобразования природных и социальных объектов в объяснении перехода одаренности от уровня «природный дар» к уровню «способности». Рассматривается вопрос преобразования малоизученного феномена «дуовекторная одаренность» в контексте более широкого понятия «одаренность». Сделана попытка раскрыть механизмы изменений природного дара ребенка, фундаментальность которых позволяет выдвинуть предположение о том, почему закономерна тенденция видов одаренности проявляться не в единственной сфере деятельности, а, оставаясь взаимосвязанными, образовывать устойчивые дуовекторные пары. Автор уточняет понятия «дуовекторная одаренность», «природный дар», «дуовекторные способности». Трактовки понятия «преобразование» в кибернетике, биологии, психологии, педагогике даны в ракурсе исходных формулировок и в проекции на исследуемый феномен дуовекторной одаренности, в его динамике, различных проявлениях. Показано отсутствие противоречий между научным обоснованием формирующейся концепции преобразования дуовекторной одаренности дошкольников и уже известными научными концепциями феномена «преобразование». Согласно материалам статьи, преобразование природного дара ребенка в дуовекторную одаренность уровня «способности» охарактеризовано как основанный на фундаментальных закономерностях существования сложных объектов и направляемый педагогической технологией процесс изменений поведения, проявляющийся в его переходе на качественно новый уровень в двух взаимосвязанных сферах.
В статье раскрывается значение воспитания в условиях современного вуза и обосновывается необходимость определения научных подходов к организации воспитательного процесса в высшей школе. Раскрываются особенности организации воспитательной работы в вузе: системность; уровневая структура; развитый институт кураторства; учет специфики вуза; целеполагание, комплексность, систематичность, последовательность воспитательной работы со студентами; реализация интерактивных технологий и методов воспитания; диагностика воспитательного процесса. Выявляются основные положения синергетического подхода в образовании (открытость системы; нелинейность; неравновесные состояния; самоорганизация; бифуркация; влияние флуктуаций), в контексте которых воспитание в вузе предстает как открытый, нелинейный и самоорганизующийся процесс. Раскрывается назначение синергетического подхода к организации воспитательного процесса в вузе, которое заключается в том, что данный подход, способствуя систематическому и последовательному обмену знаниями, ценностями между субъектами воспитания, приращению ценностной сферы сознания студентов новыми ценностями, обеспечивает создание условий для принятия студентами ответственных решений и осуществления морального выбора, являющегося предпосылкой для побуждения студентов к самовоспитанию. Выявляются основные положения ценностно-ориентационного подхода (актуализация и обогащение системы ценностей; интеграция ценностей в контекст профессиональной подготовки; учет индивидуальных ценностных особенностей студентов; развитие ценностной рефлексии студентов; проектирование ценностно-ориентированной образовательной среды), актуальные в контексте организации воспитательного процесса в высшей школе. Раскрывается назначение ценностно-ориентационного подхода к организации воспитательного процесса в вузе, которое заключается в том, что данный подход, способствуя созданию ценностно-ориентационного поля, обеспечивает развитие способности студентов ориентироваться в образующих его содержание ценностях, готовности осуществлять рефлексию процесса обмена ценностями во взаимодействии с другими людьми.
Профессиональная подготовка будущих офицеров (в том числе, и офицеров военно-оркестровой службы) является ключевым аспектом функционирования современного высшего военного образования, обеспечивающего становление и развитие высококвалифицированных специалистов, способных эффективно выполнять функционально-должностные обязанности в условиях (реалиях) ратной службы. Важное место в этой профподготовке занимают педагогические условия, которые реализуются в образовательном (учебно-воспитательном) процессе военного университета и служат основой для формирования профессиональных компетенций, личностных и профессионально значимых качеств будущих военных лидеров. В данной статье рассматриваются различные отечественные и зарубежные подходы к определению сущности профессионализма военного дирижёра, а также раскрывается содержательно-структурное наполнение понятия педагогических условий, необходимых для профессиональной подготовки будущих офицеров, и анализируются их ключевые особенности. В статье профессионализм военного музыканта рассматривается как комплексное явление, включающее в себя военно-физические, музыкально-технические, творческие и педагогические аспекты; обосновывается необходимость создания специальных педагогических условий для его формирования в контексте функционирования военных вузов; анализируются ключевые компоненты образовательного процесса военного вуза, которые влияют на эффективность профподготовки будущих офицеров военно-оркестровой службы к выполнению служебных задач.
Настоящая статья посвящена рассмотрению особенностей запуска и внедрения пилотного проекта по изменению уровней профессионального педагогического образования на основе опыта Балтийского федерального университета имени Иммануила Канта, а также эффективных практик образовательно-научного кластера «Институт образования и гуманитарных наук» Балтийского федерального университета имени Иммануила Канта, реализация которых способствует формированию и развитию профессиональной идентичности обучающихся педагогических направлений в период вузовской подготовки, первичной профессионализации студентов, формированию положительного отношения обучающихся к выбранной профессии, готовности эффективно и успешно работать в соответствующей профессиональной области, а также самостоятельно, продуктивно и осмысленно управлять процессом построения карьеры на протяжении всей своей жизни. На основе выполненного анализа особенностей организации среды поддержки профессионализации студентов в Балтийском федеральном университете имени Иммануила Канта, а также условий реализации подготовки педагогических кадров разработаны обобщенные практические рекомендации проектирования среды поддержки профессионализации студентов и формирования профессиональной идентичности будущих педагогов, которые могут быть использованы в целях решения вопросов обеспечения качества образования, в том числе преодоления разрыва содержания и результатов высшего образования с требованиями рынка труда.
Актуальность темы статьи мотивируется потребностью осмысления проблемы воспитания учащейся молодежи правдой и в правде, решение которой зависит, в частности, от знания учителем содержания понятий «правда» и «правдивость». Авторы статьи осмысливают содержания понятий «правда» и «правдивость», обращаясь к описаниям соответствующих лексем в словарях русского и французского языка, к трактовке понятий, присутствующей в немногих специальных словарях, а также учитывая функционирование понятий в современных научных и классических этико-философских текстах. Показывается, что ученые-этики употребляют понятие «правда» в значениях принципа нравственности, ценности, порядка бытия и человеческих отношений; понятие «правдивость» - в значениях морального качества и качества души (добродетели), свойства человека, морального правила и ценности. Объясняется суть ценностного конфликта, заложенного в ситуации «лжи по необходимости» или «лжи во спасение». В результате осмысления идей мыслителей и философов Древней Греции о правде и правдивости выявляется, что Гесиод и Орфей употребляют слово «правда» как имя собственное - имя богини Дикэ (Правда) для обозначения правосудия и возмездия, порядка в природе и временах года; Гераклит - в значении справедливого возмездия, справедливости; Парменид - справедливости; Протагор - добродетели; Платон - блага; Аристотель - приговора и расплаты. Платон употребляет слово «правдивость» в значении способности совершать поступок; Аристотель - добродетели. Знание содержания понятий «правда» и «правдивость» важно для теории воспитания в части, относящейся к обоснованию культурологического содержания воспитания правдой и в правде, для практики воспитания - в части, относящейся не только к определению, но и к разработке методов воспитания правдой. Авторы настаивают, что одним из таких методов воспитания правдой и в правде должен стать метод практических нравственных наставлений, в частности, содержащихся в изречениях Семи мудрецов Античности, в увещевательных сочинениях Стои и других классических суждениях о правильной жизни.
Во ФГОС ООО подчеркнута практико-ориентированность современного образования, которая требует от обучающихся не только получения знаний, но и умения применять их в реальных жизненных ситуациях. В статье описывается опыт разработки, проектирования и апробации в педагогической практике компетентностных задач, основанных на методе case-study, для развития у школьников навыков социального проектирования и метанавыков. В исследовании изучалась возможность применения кейс-метода для формирования у учащихся навыков критического мышления, анализа и разработки решений социально значимых проблем. В качестве материала был использован рождественский рассказ с социальной проблематикой. Ученики 6-8 классов, работая в группах и индивидуально, анализировали проблемные ситуации и разрабатывали проектные решения, представленные затем в форме презентации. Результаты показали, что компетентностные задачи развивают у школьников гибкость мышления, способность оценивать ситуации с разных позиций и принимать аргументированные решения. В заключение авторы анализируют описанные прецеденты образовательного процесса и делают выводы о совершенствовании разработанных и апробированных материалов по внедрению метода case-study в образовательный процесс. Отмечается, что использование компетентностных задач на основе кейс-метода может быть эффективным инструментом для воспитания социальной ответственности и формирования гражданской позиции у школьников.
В данной статье рассматривается проблема построения в вузе безопасной и надежной образовательной среды, обеспечивающей не только безопасность субъектов образования, но и надежность всей образовательной системы функционирования образовательной организации высшего образования. Анализируются основные подходы к осмыслению сущности, содержания и структуры образовательной среды вуза, рассматриваются соотношения понятий безопасности, психологической безопасности, цифровой образовательной среды, проблемы их взаимовлияния и взаимообусловленности. Впервые безопасность и надежность образовательной среды рассмотрены в их взаимосвязи, как свойства единой образовательной системы, обеспечивающей эффективность функционирования организации высшего образования в период ее реформирования и необходимое условие для сохранения и повышения его качества. В статье представлены результаты мониторингового исследования удовлетворенности субъектов образования (студентов, научно-педагогических работников и работодателей) образовательной средой вуза, оценок ее безопасности и надежности, отношения к внедрению в систему учебно-воспитательного процесса нововведений, обусловленных необходимостью отклика на вызовы современности и отражающих передовые научные разработки отечественной педагогики, соотнесенные с диалектическим единством необходимости достижения мобильности системы высшего образования, ее гибкости и открытости новым тенденциям и одновременно обеспечения ее устойчивости и надежности в достижении приоритетных образовательных целей.
Представленная статья посвящена анализу научной деятельности известного отечественного ученого-медика и микробиолога Зинаиды Виссарионовны Ермольевой (1898-1974) в структуре Академии медицинских наук СССР. В статье воссоздается история появления высшего научного учреждения медицинской науки в стране, характеризуется его устройство и назначение. Анализируется вхождение З. В. Ермольевой в структуру данной академии сначала в качестве члена-корреспондента, а затем как действительного члена; устанавливаются даты избрания, а также ученые и учреждения, рекомендовавшие ее в число академиков медицины. Основное внимание уделяется наиболее значимым, магистральным направлениям исследований, которые З. В. Ермольева проводила по поручению Президиума АМН СССР. Приводится несколько частных примеров исследовательских работ ученой, выполнявшихся в период 1950-1960-х гг. В основном это вопросы изучения антибиотиков: их экспериментальное и клиническое исследование, а также разработка наиболее рациональных способов применения в медицинской практике. Устанавливаются члены научных коллективов, в рамках которых З. В. Ермольева проводила исследования, инициированные академией. Кроме опубликованных источников, в работе используются документы федеральных архивов: Российского государственного архива экономики и Российского государственного архива научно-технической документации.
В данной статье рассматривается состояние советской деревни в период новой экономической политики. Актуальность исследования обусловлена необходимостью комплексного исследования положения российского крестьянства в период подъема нэпа. Проанализированы причины и последствия неурожая 1925 г. и его влияние на настроения различных групп российского крестьянства. В статье используются документы органов государственной безопасности, периодическая печать. Исследуются действия, к которым прибегало крестьянство для выживания в условиях неурожая. Признано увеличение панических настроений среди крестьян в связи со слухами о предстоящей войне. Проанализированы отношения между городом и деревней в условиях кризиса. Рассмотрено влияние государственных структур на возникновение кризиса хлебозаготовок. Помощь государства способствовала росту доверия крестьянства к Советской власти. Экономическая поддержка деревни со стороны государства предотвратила взрыв социального недовольства. Кризис 1925 г. был вызван просчетами в планировании и являлся чисто экономическим. Вместе с тем он способствовал прекращению политики «лицом к деревне» и постепенному свертыванию нэпа. Отмечается, что источником промышленной модернизации, начавшейся с середины 1920-х гг., стало изъятие материальных средств за счет крестьян.
Тема представленной статьи связана с историческим фактом присоединения среднеазиатской территории Мерв к Российской империи в 1884 году. Это событие стало одним из заключительных этапов в присоединении Средней Азии в целом и её интеграции в состав Российской империи. Процесс этот отражён в обширной историографии, среди которой есть работы, близкие по проблематике к теме данной статьи. Автор акцентирует внимание на подготовке присоединения Мерва. Данный вопрос нашел отражение в «Сборнике географических, топографических и статистических материалов по Азии» за 1883 год. Целью исследования в данной статье является статус мервских ханов в публикациях указанного сборника. Небезынтересным представляется специальное рассмотрение вопроса о мервских ханах, предпринятое инженером, а впоследствии дипломатом и преемником Николая Валерьевича Чарыкова Павлом Михайловичем Лессаром накануне присоединения Мерва. Вопрос о статусе мервских ханов был не абстрактно-теоретическим, а имел важное практическое значение. В связи с необходимостью установить порядок в Мерве, нужно было понять - можно ли решить данную проблему без присоединения Мерва путем достижения договоренности с мервским ханом. В любом случае П. М. Лессар полагал неизбежным присоединение Мерва. Поставив в начале своей статьи вопросы о том, имеют ли реальный авторитет мервские верховные ханы и способны ли они гарантировать соблюдение договоров с русской администрацией об устройстве жизни местного населения, исключавшем разбой и другие асоциальные явления, он сформулировал заключение: на все эти вопросы возможны только отрицательные ответы. П. М. Лессар, изучивший организацию власти в Мерве, пришел к выводу, что статус верховного хана носит там номинальный характер, и выявил факторы, которые препятствовали организации системного порядка в принципе.
Статья посвящена краткому обзору сфрагистического материала Российской империи второй половины XVIII века, обнаруженного в ходе археологических раскопок в историческом центре г. Москвы по адресам: площадь Павелецкого вокзала; ул. Варварка, д. 3 («Старый» Гостиный двор); ул. Садовническая, д. 3/7; ул. Ильинка, д. 3/8 («Теплые» Торговые ряды); туп. Сытинский, д. 3 А; пер. Молочный, владение 3 в 1996-2009 гг. Пломбы Российской империи представляют собой значимые артефакты и являются ценным источником информации, свидетельствующим о развитии национальной промышленности, экономики, а также внешней и внутренней торговли. Сфрагистический материал представлен двумя видами пломб: «буллы» и «заклепки с перемычкой». «Буллы» представляют собой круглые или овальные пломбы, часто с изображением гербов или символов власти, что подчеркивает их официальный характер. Они могли использоваться как для упаковки товаров, что делало их важным элементом в системе торговли, так и для официальной документации. Заклепки с перемычкой, в свою очередь, служили для закрепления упаковки и защиты содержимого от несанкционированного доступа. Такие пломбы часто имели уникальные знаки или символы, что позволяло идентифицировать производителей или владельцев товаров. Исследование этих артефактов не только помогает понять экономические и торговые практики, фискальные процедуры того времени, но и освещает культурные и социальные аспекты жизни в Российской империи. Сфрагистический материал является важным элементом в реконструкции исторического контекста, а его анализ может дать новые знания о взаимодействии внешней и внутренней экономики и развитии государственной власти.
Работа посвящена истории исследования памятников красномостовского типа финального неолита лесной зоны Среднего Поволжья. В изучении материалов красномостовского типа выделено два этапа. На первом этапе (вторая половина 1970-х - середина 1990-х гг.) был сформирован основной корпус источников по данной проблематике и определено культурно-хронологическое положение красномостовских материалов среди комплексов неолита-неолита Волго-Камья. Наиболее дискуссионным в данный период являлся вопрос о культурном статусе красномостовских материалов. На втором этапе (конец 1990-х гг. - настоящее время) происходит сокращение полевых работ по изучению красномостовских памятников, основное внимание уделяется проблеме происхождения комплексов финального неолита и их участия в сложении средневолжского варианта волосовской культурно-исторической общности. В этот период для решения вопросов, связанных с проблемой генезиса красномостовских материалов, начинают привлекаться данные по радиоуглеродному датированию и результаты технико-технологического анализа керамической посуды. В результате работ коллектива исследователей к настоящему времени для красномостовских комплексов определено их происхождение, время существования и дальнейшая судьба. Наиболее острым является вопрос о соотношении с культурными образованиями сопредельных территорий.
В статье обобщены сведения о поселениях камской неолитической культуры, расположенных на границе двух природных зон - леса и лесостепи (Нижнее Прикамье). Исследованные памятники являются стационарными базовыми поселениями, на которых выявлены остатки шести жилых сооружений полуземляночного типа. Количество выявленных сосудов на поселениях варьирует от 3-4 (Кабы-Копры) до 311 экземпляров (Дубовогривская II). При этом на Дубовогривской II стоянке отмечены материалы как раннего, так развитого и позднего этапов. Наиболее показательны в этом плане стоянки Обсерваторская III (8 сосудов камской культуры раннего этапа) и Лебединская II (36 сосудов развитого этапа). Картография ранненеолитических комплексов камской культуры показывает широкую географию становления этой традиции: Среднее Прикамье (Мокино, Усть-Букорок), Нижнее Прикамье (Зиарат, Дубовогривская II, Муллинское II), Свияга (Кабы-Копры), Вятка (Тархан I, Усть-Шижма I) и Европейский Северо-Восток (Пезмог IV). Муллинское II поселение при этом выделяется среди памятников этого периода обилием керамической посуды, количество которой не характерно для ранненеолитического этапа. Керамика ранненеолитического этапа (А) поселений камской культуры подразделяется на типы (А1-3); керамика развитого этапа (В) в целом по своим показателям и содержанию идентична на всей территории распространения этой керамической традиции; на керамике позднего этапа (С) начинают прослеживаться инокультурные влияния, выраженные в появлении группы сосудов русско-азибейского (С2) и единичной посуды чернашкинского (С3) типов.
Керамические комплексы обозначенных в названии работы регионов в раннем и/или развитом неолите представлены сосудами, украшенными наколами различной формы. Иногда данная система орнаментации сосуществует с традицией нанесения оттисков гребенчатого штампа, ногтевидных насечек и неорнаментированной посудой, но всегда образует существенную часть коллекции той или иной стоянки. В представленной статье мы рассматриваем вопрос о том, является ли наличие накольчатого орнамента достаточным критерием для отнесения материалов к одной культуре. Ранее нами была проведена непосредственная работа с керамическими коллекциями большинства опорных стоянок Среднего Поволжья, Прикамья, Камско-Вятского и Сурско-Мокшанского междуречий. На базе типологического, формально-классификационного и статистического методов осуществлена их группировка, итоги опубликованы. Результаты нами использованы для подсчета коэффициента сходства между памятниками. Также проведены анализ соответствия и главных компонент. Данные, полученные в ходе применения обозначенных трех подходов, не противоречат друг другу. Они позволяют обосновать возможность разделения изученных памятников на две культурные традиции: волго-камскую лесную и средневолжскую лесостепную. Также допустимо ставить вопрос о выделении локальных вариантов в рамках обозначенных дефиниций: в волго-камской (Марийского, Нижнекамского и Камско-Вятского), а также двух в границах средневолжской культуры (Поволжского и Сурско-Мокшанского). При этом их наименование, содержательное наполнение и точные ареалы должны уточниться в ходе дальнейшего изучения. Предлагаемые выводы будут способствовать разрешению терминологических противоречий, возникающих при работе с неолитическими керамическими комплексами Поволжья, Прикамья и некоторых сопредельных регионов.
В статье приведены результаты четырехлетнего изучения 29 образцов зверобоя продырявленного разного географического происхождения в условиях культуры среднетаежной подзоны Республики Коми. Выявлена высокая зимостойкость растений зверобоя продырявленного первого-второго годов жизни. Отмечено значительное снижение зимостойкости большинства изучаемых образцов (до 41-68%) на третий и четвертый годы перезимовки растений. Выявлено пять зимостойких образцов - Таллин 885 и 886 (100%), Йошкар-Ола, Осло 219 и Таллин 888 (90%). Установлено, что все растения зверобоя продырявленного, выращенные рассадным способом, переходят в генеративный период на второй год жизни, регулярно цветут и плодоносят. Исследование сезонного развития зверобоя продырявленного показало, что образцы разного географического происхождения сохраняют фенологические ритмы, свойственные данному виду. Растения зверобоя продырявленного характеризуются длительными периодами цветения (39-57) и плодоношения (37-59 дней). Вегетационный период большинства образцов в зависимости от метеоусловий сезона длится 126-142 дня. Выделился один образец Таллин 885 с более коротким вегетационным периодом (100-128 дней). Приведена морфометрическая характеристика генеративного побега всех образцов у растений второго-четвертого годов жизни. Максимальные показатели флоральной части побега отмечены у образцов Барнаул, Йошкар-Ола, Сыктывкар, Таллин 885, минимальные - у сорта Солнечный и Лейпциг 379. Максимального развития растения достигали на третий год жизни. Определено суммарное содержание гиперицина и псевдогиперицина (0,04-0,06%) в растениях зверобоя продырявленного разного географического происхождения. Выявлено высокое содержание флавонолов (4,8-5,8%) в надземной сырьевой фитомассе изучаемых образцов зверобоя разного географического происхождения.
В статье рассматриваются возможности применения методов регистрации световых и индукционных кривых флуоресценции хлорофилла тест-культуры Chlorella vulgaris при проведении биотестирования токсичности проб воды. Представлены результаты биотестирования проб воды из Волынцевского водохранилища и его основных притоков. Данные представлены за период активного использования ресурсов водохранилища, что привело к значительному снижению уровня воды и ухудшению качества водных ресурсов. Исследования показали наличие хронического токсического действия проб из водохранилища на исследуемый тест-объект. Фильтрат проб воды из северных притоков Волынцевского водохранилища оказывал стимулирующее действие на культуру фитопланктона. Методы флуориметрического анализа подтверждают результаты методики биотестирования, согласуются с изменением численности клеток и содержания хлорофилла в исследуемых пробах, а также позволяют выявить негативное воздействие на фотосинтетический аппарат Chlorella vulgaris, не вызывающее изменения параметров прироста тест-культуры. Выявлено негативное воздействие проб воды из основного притока водохранилища - реки Булавин - на скорость электронного транспорта и функционирование первичных акцепторов электронов фотосистемы II клеток Chlorella vulgaris. Полученные материалы могут быть полезны для исследователей, занимающихся проблемами биофизики первичных фотосинтетических реакций, экологическим мониторингом поверхностных природных вод и биотестированием.
В статье представлены данные по исследованию колоний сурка байбака ( Marmota bobak, Muller, 1776) в весенний период 2022-2024 годов на общедоступных территориях, находящихся в Исаклинском районе Самарской области. Изучались колонии сурка, расположенные в окрестностях деревни Вербовка, их координаты ранее не отмечались исследователями, а также колонии байбака около деревень Смольково и Новая Чесноковка. Рассмотрена особенность топографии нор в данных колониях. Большая часть нор расположена на холмах и в балках западной, юго-западной, юго-восточной и южной экспозиции. Изучены особенности расположения семейных участков в данных колониях степного сурка и вероятные пути дальнейшего распространения особей. Проанализирован уровень тревожности степного сурка в четырех колониях и их зависимость от наличия асфальтированной дороги, водоема, следов браконьерства и других следов деятельности человека. Выявлена связь поведения степных сурков с наличием выпаса скота в непосредственной близости от колоний. Было подсчитано среднее число особей степного сурка в исследуемых колониях и сравнение численности с региональным коэффициентом, установленным в 2009 году.
Проведена сравнительная оценка биологических и биохимических показателей растений Stemmacantha carthamoides местной репродукции и сорта Саяны, культивируемых в условиях подзоны средней тайги Республики Коми. Показано, что в условиях культуры особи обоих образцов характеризуются высокими показателями жизненности особей, семенной продуктивности, накапливают в надземных и подземных органах достаточное количество экдистерона (не менее 0,1%). Отмечено, что почвенно-климатические условия района интродукции благоприятны для выращивания обоих изучаемых образцов St. carthamoides, и Сыктывкарская популяция может служить основой для создания нового сорта. По содержанию экдистерона в корневищах с корнями и весенних розеточных листьях Сыктывкарская интродукционная популяция не уступает сорту Саяны и превосходит последний по количеству данного вещества в семенах. В неразвернувшихся листьях массовая доля экдистерона составила не менее 0,12 ± 0,01%. Установлено, что максимальное количество экдистероидов находится в зрелых семенах St. carthamoides и их содержание зависит от образца и погодных условий вегетационного сезона (Сыктывкарская популяция - 3,04-4,28%, сорт Саяны - 2,84-2,87%). Обращено внимание на возможность извлечения экдистерона технологически более выгодным путем, используя зрелые семена St. carthamoides. Отмечена проблема ежегодного получения доброкачественных семян данного вида - защита урожая семян от склевывания вьюрками.
В интенсификации отрасли садоводства главная роль отводится клоновым слаборослым подвоям. Зеленое черенкование является основным методом размножения клоновых подвоев косточковых культур. Основой технологии зеленого черенкования является биологическая способность растений к регенерации. Технология укоренения зеленых черенков основывается на выращивании целых растений из облиственных стеблевых черенков за счет формирования новых придаточных корней. Исследования проводились в ГБУ СО НИИ «Жигулёвские сады» в период с 2021 по 2023 годы. Зеленые черенки подвойных форм высаживали в теплице площадью 18 м², с покрытием из сотового поликарбоната. Микроклимат в теплице поддерживался с помощью ультразвуковой туманообразующей установки, работающей ежедневно с 07:00 до 20:00. Объектом исследования были 10 клоновых подвойных форм для вишни и черешни, включая ВСЛ-2 [Вишня БС-2 ( P. frutikosa Pall.) × Л-2 ( P. lannesiana Wils.)], ЛЦ-52 (Любская × Церападус № 1), ЦШ-32 (Церападус № 1 × Ширпотреб черная), группы подвоев Логри (Вишне-черешня Калитвянка × Китайская черешня Карликовая ( P. pseudocerasus ) под следующими номерами: 61-72, 61-701, 61-70, 61-12, 61-740, 61-16, 61-718; 5 подвойных форм для сливы и абрикоса - Бест, Бест-2 (Микровишня низкая × Алыча ( M. besseyi × P. cerasifera ), ВВА-1 (Микровишня войлочная ( P. tomentosa Thunb.) × Алыча ( P. cerasifera Ehrh.), ВПК-1 [(Микровишня низкая × Слива карзинская ( M. besseyi × ( P. nigra × P. americana )] и Эврика 99 [Вишнеслива Сапа ( P. pumila L. × P. salicina Lindl) × алыча Отличница ( P. cerasifera Ehrh.)]. Для повышения процента укореняемости черенки предварительно обрабатывали стимуляторами корнеобразования. Черенки замачивали в водном растворе Корневина (0,6 г/л) или Гетероауксина (100 мг/л) на 16-18 часов перед посадкой для повышения укореняемости. Укоренение зеленых черенков клоновых подвоев плодовых культур осуществляли в теплице при температуре воздуха +30…+35°C, практически 100% относительной влажности воздуха и температуре почвы +25…+30°C. Зеленые черенки высаживали в теплице в субстрат по схеме 7 × 5 см на глубину 2-3 см. При такой схеме посадки на 1 м² высаживалось до 280 штук черенков. Оптимальный срок черенкования, обработка черенков стимуляторами корнеобразования, создание в теплице питательного субстрата с хорошими воднофизическими свойствами, бесперебойный режим туманообразующей установки, проведение листовых подкормок обеспечивали высокий выход, рост и развитие укорененных растений с единицы площади. Лучший результат укоренения зеленых черенков показали клоновые подвои вишни из семьи Логри (Лошадиная грива) - 61-72, 61-718, 61-740, 61-16 (соответственно 85,0%, 87,0%, 89,7% и 90,0%); сливы ВВА-1 - 80,0% и Бест-2 - 82,9%. Наименьший процент выхода укорененных растений был получен у подвоев вишни ЦШ-32 - 46,4%, подвоев сливы Эврика 99 - 57,1% и ВПК-1 - 31,6%.
Изучение распределения и численности обыкновенного бобра проведено на особо охраняемой природной территории регионального значения «Зеленая роща» (туристско-рекреационная местность) в Череповецком районе Вологодской области в 2021-2023 гг. Рассмотрены особенности бобровых поселений, их распределение, подсчитана численность бобров. Было отмечено 6 поселений обыкновенного бобра, плотность которых составила 0,14 поселений/км². Поселения расположены неравномерно на мелиоративных канавах, естественных водоемах, водоемах, созданных бобрами. Среднее количество бобров в одном поселении в «Зеленой роще» составило 3,2 ± 0,4 особей. За последнее десятилетие количество бобровых поселений на ООПТ «Зеленая роща» увеличилось с 2 до 5, при этом численность бобров возросла в 2-2,5 раза. При благоприятных условиях (достаточный запас кормовых ресурсов, не пересыхающие в летний период водоемы) количество бобровых поселений может достигать 12, плотность поселений обыкновенного бобра на ООПТ «Зеленая роща» при этом составит 0,3 поселения/км², что в 2 раза будет превышать среднюю плотность по России. В статье приведены описания бобровых поселений. Площадь поселений варьирует от 3,5 тыс. м² до 170 тыс. м². На мелиоративных канавах расположено 67% поселений, в 83% поселений построены хатки; 17% поселений не имеют нор; плотины построены в 67% бобровых поселений. Из древесно-кустарниковых растений в поселениях преобладают березы и ивы. В целом, территория ООПТ «Зеленая роща» благоприятна для проживания бобров.
В работе рассмотрены вопросы устойчивости насаждений дуба черешчатого в условиях изменяющегося климата Донбасса. Установлено, что общее состояние Quercus robur L. оценено на территории дендрария Донецкого ботанического сада (экспериментальных дубрав) как неудовлетворительное, с серьезными нарушениями в структуре дендроценоза, которые могут привести к деградации экотопа. Для остальных территорий состояние деревьев дуба черешчатого оценивается как хорошее. Растения, в том числе и деревья пирамидальной формы, проявляют высокую стойкость к антропогенным нагрузкам. Флуктуирующая асимметрия листовых пластин как показатель устойчивости растений коррелирует с состоянием древесных растений, а также имеются предпосылки к утверждению, что и со степенью повреждения листового аппарата дендрофильными насекомыми. В свою очередь, вредители влияют на стабильность развития дуба черешчатого в различных экотопах города Донецка. Установлено, что характерные повреждения дубовой широкоминирующей молью Acrocercops brongniardella (Fabricius, 1798) приводят к уменьшению полезной площади листа, что отражается на ухудшении фотосинтетической активности и показателе фотохимической эффективности (квантовый выход флуоресценции). Установлено, что уровень минимальной флуоресценции для листовых пластин без повреждения вредителями в среднем выше на 20,5% и отражает количество хлорофилла в вегетативном органе.
Были проведены исследования поступления пыльцы в атмосферу 11 видов злаков семейства Poaceae Barnh. (=Gramineae Juss.) и 5 видов осок семейства Cyperáceae Juss. Изученные растения произрастают в коллекции «Газонные и декоративные злаки» лаборатории интродукции декоративных растений Центрального сибирского ботанического сада Сибирского отделения Российской академии наук (ЦСБС СО РАН). Они активно используются как компоненты газонных культурфитоценозов и представляют группу декоративных злаков и осок. Будучи доминантами природных растительных сообществ, они образуют огромное количество пыльцы, которая является одним из основных источников аллергических болезней, вызывая сезонные поллинозы. Пыление, распространение и скорость переноса частиц зависит от состава пыльцы. Актуальность изучения этого вопроса привлекает не только аллергологов, но и ученых-ботаников. В результате работы исследован состав пыльцы злаковых и осоковых растений на наличие кластеров и определены доли кластеров и отдельных пыльцевых зерен от общего числа пыльцевых частиц, попадающих в атмосферу во время цветения растений. Наши исследования показали, что во всех проанализированных образцах присутствуют кластеры пыльцы. Экспериментальный анализ состава пыльцы злаков показал, что доля кластеров может варьироваться от 11,5% у Arrhenatherum elatius до 35,4% у Panicum capillare. При этом доля пыльцевых зерен у этих видов составляет соответственно от 28,2% до 67,6% от общего количества пыльцевых частиц (836; 1086). Что касается изученных видов осок, то здесь кластерный состав может изменяться от минимального значения в 28,6% у Carex vesicaria до максимального в 67,9% у Carex altaica. а доля пыльцевых зерен варьируется от 52,7% до 90,8% от всех пыльцевых частиц (760; 467).
Паразитиформные клещи рода Ixodes являются достаточно распространенной и обширной группой членистоногих. Известно, что иксодовые клещи вызывают особый интерес как переносчики и длительные хранители возбудителей различных природно-очаговых болезней: вируса клещевого энцефалита (ВКЭ), иксодового клещевого боррелиоза (ИКБ), туляремии, моноцитарного эрлихиоза человека и др. Еще в сороковые годы XX столетия уделялось пристальное внимание к изучению кровососущих членистоногих - иксодовых клещей в Среднем Поволжье. Результаты исследований, проведенных в регионе в конце XX - начале XXI в., выявили тенденцию к замещению одних видов другими и, как следствие, переселение и изменение границ ранее привычных ареалов. В акарифауне Республики Татарстан встречаются виды: Ixodes persulcatus Schulze, 1930; Ixodes ricinus Linnaeus, 1758; Dermacentor reticulatus Fabricius, 1794; Ixodes lividus Koch, 1844; Dermacentor marginatus Sulzer, 1776; Dermacentor silvarum Olenev, 1931; Dermacentor nuttalli Olenev, 1928; Ixodes trianguliceps Birula, 1895 и другие. Антропогенная трансформация естественных лесонасаждений динамично отражается на зоогеографии и распространении переносчиков природно-очаговых инфекций ( I. persulcatus, I. ricinus ). Происходят сложные преобразовательные процессы по замещению популяций таежного клеща I. persulcatus его конкурентоспособным экологически близким видом - лесным клещом I. ricinus. Это способствует эпидемической и эпизоотической валентности природных очагов.
Показано, что одной из проблем г. Оренбурга в настоящее время остается отчуждение земель под полигон ТКО, воздействие полигона на атмосферный воздух и подземные воды. Установлено, что для обеспечения экологической безопасности в г. Оренбурге организован раздельный сбор мусора в контейнеры. ТКО поступают на полигон от частных и многоэтажных жилых домов города, от муниципальных образований, входящих в состав города, от предприятий и организаций. На полигон ТКО вывозятся отходы контейнеров для мусора, на полигоне проводится сортировка поступающих отходов, переработка отходов не производится. Установлено, что в морфологическом составе поступающего мусора из контейнеров более 80% отходов составляют использованные полимерные материалы, стекло и бумага, которые в городе собираются раздельно в контейнеры, пищевые и разлагаемые органические материалы. Доля разлагаемых в окружающей среде органических материалов в ТКО составляет 40,5%, их раздельный сбор в городе не производится. Подсчитано, что для переработки образующихся ежегодно отходов потребуется 18 биогазовых установок КОБОС-1, одна установка по переработке стекла ТОСС, 4 установки по переработке пластика СТАНКО-2000, 5 установок по переработке макулатуры БДМ-3. Расчетами показано, что переработка ТКО после сортировки позволит получить 33974 т/год биогаза, 14541 т/год листового стекла, 22425,6 т/год изделий из пластика, 15330 т/год изделий из бумаги и сократить площадь отчуждаемых под полигон земель.
Статистика статьи
Статистика просмотров за 2025 год.
Издательство
- Издательство
- СГСПУ
- Регион
- Россия, Самара
- Почтовый адрес
- 443099, Самарская область, город Самара, ул. Максима Горького, д.65/67
- Юр. адрес
- 443099, Самарская область, город Самара, ул. Максима Горького, д.65/67
- ФИО
- Бакулина Светлана Юрьевна (РЕКТОР)
- E-mail адрес
- rectorat@sgspu.ru
- Контактный телефон
- +7 (846) 2074400
- Сайт
- https://sgspu.ru