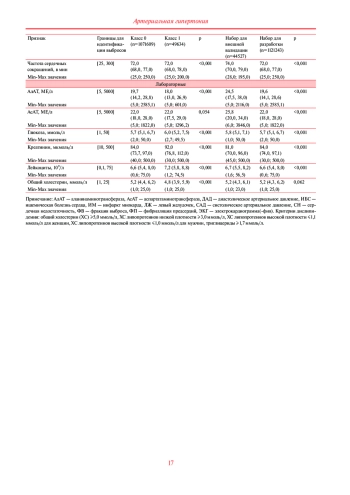
Цель. Разработать с использованием алгоритмов машинного обучения модели прогнозирования госпитализаций пациентов с артериальной гипертензией (АГ) в течение 12 мес. и провести их валидацию на данных реальной клинической практики.
Материал и методы. По сведениям из деперсонифицированных электронных медицинских карт, полученных из платформы Webiomed, отобрано 1165770 записей 151492 пациентов с АГ. В качестве предикторов, после первоначальной селекции, были использованы анамнестические, конституциональные, клинические, инструментальные и лабораторные данные, широко применяемые в рутинной врачебной практике, всего 43 признака. Для создания моделей применялись инструменты автоматического машинного обучения. Рассматривался широкий набор алгоритмов, включая логистическую регрессию, методы, основанные на деревьях решений c использованием градиентного бустинга и бэггинга, дискриминантный анализ, алгоритм на основе нейронных сетей и наивный байесовский классификатор. Для внешней валидации использованы данные отдельного региона.
Результаты. Наилучшие результаты показала модель XGBoost, достигнув AUROC (площадь под характеристической кривой) 0,849 (95% доверительный интервал: 0,825-0,873) при внутреннем тестировании и 0,815 (95% доверительный интервал 0,797-0,835) при внешней валидации.
Заключение. В результате исследования разработана новая высокоточная модель прогнозирования госпитализации пациентов с АГ по данным реальной клинической практики. Результаты внешней валидации предложенного прогностического инструмента показали относительную устойчивость к новым данным из другого региона, что в совокупности с показателями качества отражает возможность ее апробации в реальной клинической практике.
Идентификаторы и классификаторы
Артериальная гипертензия (АГ) — это синдром повышения систолического (САД) артериального давления (АД) ≥140 мм рт. ст. и/или диастолического АД (ДАД) ≥90 мм рт. ст., обусловленный известной причиной (вторичная АГ), либо не связанный с выявлением явных причин, приводящих к развитию вторичных форм АГ (гипертоническая болезнь) [1].
Список литературы
1. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. DOI: 10.15829/1560-4071-2020-3-3786
2. Gaziano TA, Bitton A, Anand S, et al. The global cost of nonoptimal blood pressure. J Hypertens. 2009;27:1472-7. DOI: 10.1097/HJH.0b013e32832a9ba3
3. Wang G, Fang J, Ayala C. Hypertension-associated hospitalizations and costs in the United States, 1979-2006. Blood Pressure. 2014;23:126-33. DOI: 10.3109/08037051.2013.814751
4. Lee W, Lee J, Lee H, et al. Prediction of hypertension complications risk using classification techniques. Ind Eng Manag Syst. 2014;13:449-53. DOI: 10.7232/iems.2014.13.4.449
5. Feng Y, Leung AA, Lu X, et al. Personalized prediction of incident hospitalization for cardiovascular disease in patients with hypertension using machine learning. BMC Med Res Methodol. 2022;22:325. DOI: 10.1186/s12874-022-01814-3
6. Lee SJ, Lee SH, Choi HI, et al. Deep learning improves prediction of cardiovascular disease-related mortality and admission in patients with hypertension: analysis of the Korean National Health Information Database. J Clin Med. 2022;11:6677. DOI: 10.3390/jcm11226677
7. Wu X, Yuan X, Wang W, et al. Value of a machine learning approach for predicting clinical outcomes in young patients with hypertension. Hypertension. 2020;75:1271-8. DOI: 10.1161/HYPERTENSIONAHA.119.13404
8. Ren Y, Fei H, Liang X, et al. A hybrid neural network model for predicting kidney disease in hypertension patients based on electronic health records. BMC Med Inform Decis Mak. 2019;19:51. DOI: 10.1186/s12911-019-0765-4
9. Park J, Kim JW, Ryu B, et al. Patient-level prediction of cardio-cerebrovascular events in hypertension using Nationwide Claims Data. J Med Intern Res. 2019;21:11757. DOI: 10.2196/11757
10. Lacson RC, Baker B, Suresh H, et al. Use of machine-learning algorithms to determine features of systolic blood pressure variability that predict poor outcomes in hypertensive patients. Clin Kidney J. 2019;12:206-12. DOI: 10.1093/ckj/sfy049
11. Chen R, Yang Y, Miao F, et al. 3-year risk prediction of coronary heart disease in hypertension patients: a preliminary study. 2017 39th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2017;1182-5. DOI: 10.1109/EMBC.2017.8037041
12. Moons KGM, Altman DG, Reitsma JB, et al. Transparent Reporting of a multivariable prediction model for Individual Prognosis or Diagnosis (TRIPOD): explanation and elaboration. Ann Intern Med. 2015;162:W1-73. DOI: 10.7326/M14-0698
13. Андрейченко А. Е., Ермак А. Д., Гаврилов Д. В. и др. Разработка и валидация моделей машинного обучения, прогнозирующих риск госпитализации пациентов с сахарным диабетом в течение последующих 12 месяцев. Сахарный диабет. 2024;27(2):142-57. DOI: 10.14341/DM13065
14. Андрейченко А. Е., Лучинин А. С., Ившин А. А. и др. Разработка и валидация моделей прогнозирования общего риска преэклампсии и риска ранней преэклампсии с использованием алгоритмов машинного обучения в первом триместре беременности. Акушерство и гинекология. 2023;2:94-107. DOI: 10.18565/aig.2023.101
15. Sokolova M, Lapalme G. A systematic analysis of performance measures for classification tasks. Information Processing & Management. 2009;45:427-37. DOI: 10.1016/j.ipm.2009.03.002
16. Zoubir AM, Iskander DR. Bootstrap Methods and Applications: A Tutorial for the Signal Processing Practitioner. IEEE Signal Processing Magazine. 2007;24:10-9. DOI: 10.1109/MSP.2007.4286560
17. Ding Y, Simonoff JS. An investigation of missing data methods for classification trees applied to binary response data. J Mach Learn Res. 2010;11:131-70. DOI: 10.1145/1756006.1756012
18. Cao XH, Stojkovic I, Obradovic Z. A robust data scaling algorithm to improve classification accuracies in biomedical data. BMC Bioinformatics. 2016;17. DOI: 10.1186/s12859-016-1236-x
19. Amorim LB, Cavalcanti GD, Cruz RM. The choice of scaling technique matters for classification performance. Appl Soft Comput. 2023;133. DOI: 10.1016/j.asoc.2022.109924
20. Weiss GM. Foundations of Imbalanced Learning. In: Haibo H, Yunqian M. Imbalanced Learning: Foundations, Algorithms, and Applications. USA: John Wiley & Sons. 2013:13-41. ISBN: 978-1-118-07462-6
21. Gain U, Hotti V. Low-code AutoML-augmented data pipeline - a review and experiments. JPCS. 2021;1828. DOI: 10.1088/1742-6596/1828/1/012015
22. Bergstra J, Bengio Y. Random search for hyper-parameter optimization. J Mach Learn Res. 2012;13:281-305.
23. Lundberg SM, Erion G, Chen H, et al. From local explanations to global understanding with explainable AI for trees. Nat Mach Intell. 2020;2:56-67. DOI: 10.1038/s42256-019-0138-9
24. Fischer BG, Evans AT. SpPin and SnNout are not enough. It’s time to fully embrace likelihood ratios and probabilistic reasoning to achieve diagnostic excellence. J Gen Inter Med. 2023;38:2202-4. DOI: 10.1007/s11606-023-08177-5
Выпуск
Другие статьи выпуска
Цель. Изучение взаимосвязи между уровнем госпитализаций, тяжелого течения и летальности от COVID-19 (Corona VIrus Disease 2019) с частотой курения в Российской Федерации (РФ) за 2020-2021гг.
Материал и методы. Проанализированы данные о числе госпитализированных COVID-19, переведенных в отделение реанимации и интенсивной терапии (ОРИТ) и умерших от COVID-19 за 2020-2021гг по половозрастным группам в 85 субъектах РФ из Федерального регистра лиц, больных новой коронавирусной инфекцией COVID-19 (регистр COVID-19), а также данные о статусе курения, социально-демографических характеристиках выборки за 2020-2021гг по 85 субъектам РФ из базы микроданных “Выборочного наблюдения состояния здоровья населения” Федеральной службы государственной статистики за соответствующие годы. Проведен анализ взаимосвязей частоты курения с уровнем госпитализации с COVID-19, тяжелых COVID-19 — с переводом в ОРИТ и уровнем летальности COVID-19 по половозрастным группам населения и федеральным округам (ФО) РФ. Оценка выполнялась с помощью полиномиальной регрессии второго порядка (квадратичная регрессия). Качество модели определялось, исходя из величины коэффициента детерминации R2 и F-критерия для общей модели.
Результаты. Получены нелинейные взаимосвязи между исследуемыми показателями с характерной параболической зависимостью. Выявлена статистически значимая связь между частотой курения и уровнем тяжелых COVID-19 среди мужчин в возрастных группах 20-29 лет, 50-59 лет, 70-79 лет (p<0,05). Выявлена связь летальности от COVID-19 с частотой курения у мужчин в возрасте 15-19 лет (R2=0,15, p=0,049) более значимая у женщин (R2=0,35, p=0,002); у женщин 30-39 лет (R2=0,06, p=0,007); у мужчин и женщин 40- 49 лет и 50-59 с более выраженным трендом; у мужчин 60-69 лет (R2=0,05, p=0,018) и у женщин в качестве тенденции (R2=0,03, p=0,078); а также у женщин 70-79 лет и ≥80 лет (R2=0,06, p=0,039) с более выраженным трендом у мужчин. Выявлены положительные ассоциации между частотой курения и уровнем госпитализации COVID-19 (R2=0,52, p<0,001) и тяжелых COVID-19 (p=0,011) в Дальневосточном ФО среди мужчин, а также в Сибирском ФО (p=0,007) и Уральском ФО. Связи между уровнем летальности от COVID-19 и частотой курения в различных ФО демонстрируют обратную параболическую зависимость.
Заключение. Взаимосвязи между частотой курения и показателями COVID-19 сложны и нелинейны. Глубокий сегментированный анализ этих взаимосвязей позволил выявить значимые ассоциации, объясняющие вклад курения в уровень госпитализаций и тяжелых исходов, летальности от COVID-19 в отдельных возрастных группах мужчин и женщин и в различных ФО РФ. Эффективные меры антитабачной политики, направленные на сокращение курения необходимы для смягчения неблагоприятных последствий коронавирусных инфекций.
Гипертрофия левого желудочка (ГЛЖ), являющаяся основным проявлением гипертензивной болезни сердца, регистрируется у 15- 45% пациентов с артериальной гипертензией (АГ), достигая 77% у больных с резистентной АГ, сопутствующим сахарным диабетом 2 типа и перенесенным сердечно-сосудистым событием. В представленном обзоре изложены основные вопросы определения, патофизиологии, эпидемиологии, диагностики и регрессии ГЛЖ на фоне антигипертензивной терапии. Приводятся рекомендации, критерии выявления, преимущества и недостатки электрокардиографии и эхокардиографии в ведении больных с АГ и ГЛЖ. Особое внимание в обзоре уделено обсуждению влияния ГЛЖ на сердечно-сосудистый прогноз и обоснованности регрессии гипертрофии. ГЛЖ нередко протекает с отсутствием или со стертыми клиническими проявлениями, однако со временем увеличивает риск развития сердечной недостаточности, фибрилляции предсердий, ишемической болезни сердца, внезапной сердечной смерти, инсульта и смерти от всех причин. Отмечается, что благодаря своевременному и адекватному применению антигипертензивной терапии удается не только снизить артериальное давление, но и добиться регрессии ГЛЖ, что благоприятно влияет на исход заболевания. Представлены основные группы лекарственной терапии, вызывающей регрессию ГЛЖ, среди которых подробно обсуждаются блокаторы ренин-ангиотензинальдостероновой системы (ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II, включая в комбинации с ингибитором неприлизина), β-адреноблокаторы, блокаторы кальциевых каналов, ингибиторы натрий-глюкозного котранспортера 2 типа и диуретики.
Представлен клинический случай пациента 70 лет, у которого экссудативно-констриктивный перикардит дебютировал с момента вакцинации от SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), и в течение полугода прогрессировал в виде нарастания отечно-асцитического синдрома, рефрактерного к терапии. Через год, после перенесенного COVID-19 (COrona VIrus Disease 2019), отмечались признаки нарастания сердечной недостаточности, сопровождающиеся повышением уровня провоспалительных маркеров, индикаторов повреждения сердечной мышцы. Диагноз экссудативно-констриктивного перикардита выставлен еще через 9 мес. на стадии анасарки. Трудности диагностики заключались в том, что перикард оставался неутолщенным по данным радиологических методов, имелись расхождения в данных мультиспиральной компьютерной томографии (МСКТ) и эхокардиографии. Проведена декортикация сердца, однако в течение 2 мес. после операции не было достигнуто значимого регресса отечно-асцитического синдрома (ОАС), сохранялось повышение уровней маркеров воспаления, что было расценено как полисерозит. Было решено назначить противовоспалительную терапию анакинрой и колхицином с успешным разрешением ОАС в течение 2 мес. Генно-инженерный препарат был постепенно отменен, прием колхицина продолжен до года. При контрольных обследованиях через 6, 12, 18 мес. обострений не наблюдалось, функциональный класс сердечной недостаточности сохраняется на уровне NYHA (New York Heart Association) 1. Пациент получает минимальную терапию в виде: эплеренон 25 мг, торасемид 5 мг и аторвастатин 20 мг.
Заключение. Особенность течения перикардита в данном клиническом случае заключается в быстро прогрессирующем нарастании с весьма скудными проявлениями воспалительной реакции, прогрессировании при повторной стимуляции антигенами вирусов, быстрым развитием констрикции без значимого утолщения листков перикарда. Сохраняющийся полисерозит может быть причиной резистентного к терапии ОАС у пациентов после перикардэктомии. Следует учитывать возможность наличия торпидного воспаления у пациентов с ОАС.
Мнение авторского коллектива, изложенное в конце публикации в виде 4-х ключевых позиций, сводится фактически к отрицательному ответу на первый вопрос о быстром снижении повышенного артериального давления (АД) [1]. Гораздо интереснее ответ на второй вопрос, если быстро не снижать? Следует сразу отметить, что мы обсуждаем вариант “неосложненного гипертонического криза” или выявление при случайном или плановом измерении высоких значений АД при отсутствии клинических проявлений или при наличии минимальных симптомов, традиционно ассоциирующихся с высоким АД. Тема, по которой излагается мнение авторов, безусловно, важна и эту инициативу стоит приветствовать. Для лучшего понимания ситуации я решил адресовать коллег, читателей журнала к современным клиническим рекомендациям по ведению пациентов с артериальной гипертонией (АГ), в которых эксперты дают советы по ведению пациентов в подобной ситуации. Это то, к чему призывают авторы этой публикации.
Вопреки положениям современных руководств по лечению артериальной гипертонии в реальной клинической практике нередко применяются пероральные и сублингвальные гипотензивные препараты для быстрого снижения бессимптомного или малосимптомного повышения артериального давления (АД). Врачи и пациенты объясняют это необходимостью “купировать неосложненный гипертонический криз” ради профилактики сердечно-сосудистых катастроф. Данные клинических исследований свидетельствуют о том, что подобный подход, как назначение короткодействующих препаратов на амбулаторном приёме или в стационаре, так и рекомендации по ситуационному самолечению АГ, не только не приносит пользу пациенту, но и, вероятно, сопряжён с повышением риска сердечно-сосудистых осложнений. Смещение акцента в лечении АГ с улучшения прогноза в долгосрочной перспективе на сиюминутное снижение АД может повышать краткосрочную вариабельность АД, что является возможным механизмом развития осложнений при использовании быстродействующих пероральных гипотензивных препаратов. В статье обосновывается неприемлемость практики “неотложного” снижения АД пероральными и сублингвальными гипотензивными препаратами. Описаны рациональные действия врача в случае выявления у пациента бессимптомного или малосимптомного повышения АД и представлены возможные подходы к домашнему самоконтролю АД в соответствии с современными клиническими руководствами. Также описана тактика лечения истинных гипертонических кризов (неотложных гипертонических состояний) в зависимости от характера поражения органов-мишеней.
Цель. Изучение эффективности стратификации сердечно-сосудистого риска (ССР) с использованием шкалы SCORE2 (Systematic Coronary Risk Evaluation2 (обновленная шкала “Систематическая оценка коронарного риска”) в популяционной выборке взрослого населения г. Томск по результатам 5-летнего наблюдения.
Материал и методы. Проанализированы результаты обследования популяционной выборки из 971 человек в возрасте от 40 до 64 лет в г. Томск в рамках исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации). На основе клинико-анамнестических данных о наличии атеросклеротических сердечно-сосудистых заболеваний (с учетом и без учета результатов ультразвукового исследования (УЗИ) сонных артерий (СА)), а также сахарного диабета (СД) или хронической болезни почек (ХБП) определены лица с высоким и очень высоким риском. ССР у относительно здоровых лиц оценили по шкале SCORE2. Частоту сердечно-сосудистых событий (ССС)-смерть от ССЗ, нефатальный инфаркт миокарда (ИМ) или инсульт (n=34) определяли в разных группах риска по результатам 5-летнего наблюдения.
Результаты. Наличие ишемической болезни сердца зарегистрировано у 140 обследованных (15%), СД 2 типа у 137 человек (14%), ХБП у 217 (22%), ИМ или инсульт в анамнезе — у 5,3%. К категории высокого и очень высокого ССР по клинико-анамнестическим данным отнесено 400 обследованных (41%), на долю которых приходится 22 из 34 (65%) ССС за 5-летний период наблюдения. Использование критерия наличия атеросклеротической бляшки (АСБ), выявленного у 386 обследованных (40%), расширило эту группу до 605 человек (62%), на долю которых приходится 30 из 34 (88%) ССС за время наблюдения (частота 5%), что значимо увеличило выявление лиц с ССС (р=0,04). По шкале SCORE2 из 366 относительно здоровых лиц у 98% определен высокий и очень высокий риск, но частота ССС у них за период наблюдения составила всего 1% (р=0,004).
Заключение. Результаты 5-летнего наблюдения продемонстрировали эффективность современного алгоритма стратификации ССР в популяционной выборке г. Томск в возрасте от 40 до 64 лет в выявлении лиц высокого и очень высокого риска по клинико-анамнестическим данным с учетом результатов УЗИ СА, на долю которых приходится бóльшая часть (88%) ССС (смерть от ССЗ, нефатальный ИМ, инсульт). Шкала SCORE2 определила высокий и очень высокий риск у 98% относительно здоровых лиц, в то время как частота ССС у них составила всего 1% за 5 лет наблюдения, что не подтверждает эффективность и целесообразность применения шкалы SCORE2 при стратификации ССР.
Цель. Изучить значение провоспалительных маркеров, уровня галектина-3, показателей липидного спектра, сердечно-сосудистого статуса и их взаимосвязи у пациентов с лимфомами до начала специфической противоопухолевой терапии, сопоставить значения изученных показателей с результатами данных пациентов со схожим кардиальным статусом без онкологического заболевания.
Материал и методы. В исследование было включено 2 группы пациентов: основная группа (n=30) — пациенты с впервые установленным лимфопролиферативным заболеванием (ЛПЗ), группа сравнения (n=30) — пациенты со схожими факторами риска и/или доказанной кардиоваскулярной патологией, без онкологического заболевания в анамнезе. Всем включенным в исследование проведено определение маркеров воспаления, липидограммы и специальных маркеров (концентрация интерлейкина-6 (ИЛ-6) и галектина-3).
Результаты. Включенные в исследование пациенты обеих групп были сопоставимы по возрасту, полу, факторам риска сердечно-сосудистого заболеваний, кардиальной терапии. Определено, что у пациентов основной группы уровень потенциально проатерогенных липидов в группе пациентов с лимфомами был несколько выше, чем в группе сравнения, хотя различия не достигли статистической значимости (p>0,05); достоверно выше были — уровни белков острой фазы (С-реактивный белок, ферритин, фибриноген), скорость оседания эритроцитов (р<0,05 для всех показателей), ИЛ-6 (p=0,032), маркера фиброза — галектина-3 (p=0,001). Внутригрупповой анализ в группе ЛПЗ в зависимости от международных прогностических индексов для лимфом (IPI/MIPI/FLIPI — International Prognostic Index/Mantle cell Lymphoma International Prognostic Index/Follicular Lymphoma International Prognostic Index) продемонстрировал, что уровни галектина-3 и ИЛ-6 оказались выше у пациентов с худшими показателями прогноза ЛПЗ. В ходе корреляционного анализа выявлена прямая умеренной силы взаимосвязь между галектином-3 и ИЛ-6 (r=0,488; p=0,016).
Заключение. В ходе исследования было показано, что исследуемые группы по уровню потенциально проатерогенных липидов статистически значимо не различались. Результаты сравнительного анализа демонстрируют, что концентрация галектина-3 и ИЛ-6 при ЛПЗ значимо выше относительно данных группы сравнения, их высокий уровень может являться отражением активности опухолевого процесса. Значение данных биомаркеров в развитии кардиоваскулотоксических осложнений у пациентов с ЛПЗ на данный момент не изучено и представляется интересным с точки зрения их возможной предикторной роли в развитии сердечно-сосудистых осложнений химиотерапии.
Цель. Оценить возможность исследования уровня свободных нуклеотидов в плазме крови в качестве дополнительных биомаркеров хронической сердечной недостаточности (ХСН) с учетом клинико-инструментальных данных пациента, а также проанализировать его изменение на фоне терапии.
Материал и методы. В исследование включены 67 пациентов с ХСН и 23 здоровых добровольца. Содержание свободных нуклеотидов в плазме крови анализировали хроматографическим методом на автоматизированной системе FPLS® System (Швеция), колонка 10 × 200 мм с Q Sepharose Fast Flow. Повторный анализ выполняли у пациентов со сниженной фракцией выброса через 6±0,2 мес.
Результаты. У пациентов с ХСН по сравнению с контрольной группой выявлены более низкие уровни аденозина — 30,45±2,61 vs 56,68±3,99 мм2 (p=0,001), аденозинмонофосфата — 278,60±18,60 vs 391,68±39,86 мм2 (p=0,022), гуанозиндифосфата — 500,27± 22,83 vs 901,63±51,09 мм2 (p=0,001), аденозинтрифосфата — 49,25±8,89 vs 145,18±18,80 мм2 (p=0,001), гуанозинтрифосфата — 32±8,25 vs 92,40±27,07 мм2 (p=0,041) и более высокие значения аденозиндифосфата — 690,10±57,41 vs 392,09±32,63 мм2 (p=0,002). Данные закономерности сохранялись при анализе с учетом фракции выброса, функционального класса и наличия сахарного диабета. На фоне лечения уровни аденозиндифосфата и гуанозиндифосфата достоверно изменяются (до 307±26,08 мм2 и 650,47±58,1 мм2, соответственно), приближаясь к значениям в контрольной группе.
Заключение. Выявленные особенности нуклеотидного профиля при ХСН позволяют рассматривать уровень свободных нуклеотидов как дополнительный потенциальный биомаркер, отражающий объективные нарушения на клеточном уровне.
Цель. Сердечная недостаточность (СН) — это сложный клинический синдром, проявляющийся такими симптомами, как одышка и утомляемость. Его причиной развития могут быть различные состояния, которые влияют на наполнение желудочков (диастолическая дисфункция) или сократимость миокарда (систолическая дисфункция). Кроме того, могут присутствовать такие клинические признаки, как хрипы в легких, периферические отеки или расширение яремных вен. Целью настоящего исследования была оценка влияния дапаглифлозина на уровень сывороточного N-концевого промозгового натрийуретического пептида (NT-proBNP) при острой декомпенсированной СН (ОДСН) и его связь с массой тела.
Материал и методы. Исследование проводилось в период с октября 2023г по апрель 2024г на базе кардиологического центра Эн-Насирии (Ди-Кар, Ирак) в условиях отделения коронарной терапии. 100 пациентов, как мужчин, так и женщин, были включены в исследование после описания целей исследования, оценки удовлетворенности пациентов и получения информированного согласия. 100 пациентов, включенных в исследование, были разделены на две группы: контрольная группа (группа А) — 50 пациентов, которым вводили внутривенно фуросемид (120 мг/сут.), и исследуемая группа (группа В) — 50 пациентов, которые получали фуросемид внутривенно (120 мг/сут.) в сочетании с дапаглифлозином внутрь (10 мг) ежедневно.
Результаты. Было обнаружено значительное снижение массы тела и индекса массы тела (ИМТ) пациентов на 4-й день госпитализации по сравнению с днем поступления в обеих группах (А и В). Однако масса тела и ИМТ пациентов группы B на 4-й день госпитализации были значительно ниже по сравнению с 4-м днем госпитализации в группе A. На 4-й день госпитализации уровень NTproBNP в сыворотке крови у пациентов группы B был значительно ниже по сравнению с пациентами группы A. Было обнаружено, что дапаглифлозин, по сравнению с контрольной группой, снижал уровень NT-proBNP у пациентов с СН с низкой фракцией выброса (СНнФВ).
Заключение. Дапаглифлозин снижал риск событий, ассоциированных с СН, и риск сердечно-сосудистой смерти, а также улучшал симптомы по всему спектру исходных уровней NT-proBNP. Также была подтверждена сильная ассоциация между более высокими уровнями NT-proBNP и худшими исходами при СНнФВ. Поскольку масса тела и NT-proBNP снижались на 4-й день терапии, потеря жидкости происходила в то же время. Настоящее исследование показало положительный эффект дапаглифлозина на снижение уровня NT-proBNP и веса у пациентов с ОДСН.
Цель. Выявление маркеров развития пробежек желудочковой тахикардии (ЖТ), создание многофакторной модели прогнозирования аритмических событий у больных инфарктом миокарда (ИМ) на госпитальном этапе.
Материал и методы. Объектом исследования стали 80 больных ИМ в возрасте 55,6±8,7 лет. Обследование проводили на 7-9 сут. ИМ: эхокардиография, оценка глобальной продольной деформаци (GLS), магнитно-резонансная томография (МРТ) сердца с применением внутривенного контрастного вещества, определение концентрации N-концевого промозгового натрийуретического пептида (NT-proBNP). При многосуточном мониторировании электрокардиограммы (ММ ЭКГ) в течение 72 ч выявляли пробежки ЖТ, выполнялся анализ микровольтной альтернации зубца Т (МАТ), турбулентности сердечного ритма, поздних потенциалов желудочка, вариабельности сердечного ритма, хронотропной нагрузки сердца, дисперсии QT. Конечной точкой считали наличие ≥1 эпизода ЖТ (≥3 комплекса QRS) по данным ММ ЭКГ.
Результаты. У 10 (12,5%) больных, которые составили группу “ЖТ”, были зарегистрированы неустойчивые пробежки ЖТ. Остальные 70 (87,5%) человек, не имевших эпизодов ЖТ, вошли в группу сравнения — “С”. По данным МРТ установлено, что масса рубцовой ткани — 36,8±23,7 г и её процентное содержание — 28,5±19,8% в группе “ЖТ” было выше, чем в группе “С” — 16,9 (6,5; 27,9) г (р=0,025) и 13,3 (5,8; 22,2)% (р=0,045), соответственно. По данным однофакторного регрессионного анализа установлены факторы, ассоциированные с риском ЖТ: ишемическая болезнь сердца в анамнезе, высокие значения NT-proBNP, турбулентности сердечного ритма, МАТ, конечный диастолический размер, GLS, масса рубцовой ткани, рубцовая зона от общей массы миокарда (%), параметры вариабельности сердечного ритма в ночные часы — ULfP, TINN, SDANN.
Заключение. Предложена многофакторная модель прогнозирования неустойчивой ЖТ у больных ИМ, включающая следующие параметры: конечный диастолический размер, МАТ, NT-proBNP, GLS, массу рубцовой ткани и наличие ишемической болезни сердца в анамнезе.
Цель. Оценить количественные и радиомические характеристики абдоминальной висцеральной жировой ткани (ВЖТ) методом магнитно-резонансной томографии, их взаимосвязь с показателями липидного, углеводного обмена, воспаления у пациентов с ишемической болезнью сердца (ИБС), а также ассоциацию этих факторов с наличием или отсутствием лептинорезистентности (ЛР).
Материал и методы. В исследование включены 46 пациентов со стабильной ИБС. Для определения объема (см3) абдоминальной жировой ткани выполняли магнитно-резонансную томографию. В сыворотке крови определяли уровень глюкозы и инсулина, липидный профиль, уровень провоспалительных маркеров и адипокинов. Для количественной оценки наличия ЛР рассчитывали индекс свободного лептина (ИСЛ) (при ИСЛ >25 — наличие ЛР).
Результаты. Выявлено, что в группе с ЛР статистически значимо были выше значения индекса массы тела и индекса НОМА-IR (Homeostasis model assessment of insulin resistance), уровень инсулина, адипонектина, лептина и выше ИСЛ, тогда как соотношение адипонектин/лептин и уровень рецепторов к лептину в крови были ниже, чем в группе пациентов без ЛР. Межгрупповых различий по объему абдоминальных жировых депо выявлено не было. Группа с ЛР характеризовалась статистически значимо меньшим значением таких радиомических характеристик, как Entropy (Энтропия) и Variance (Дисперсия). В модель многофакторного логистического регрессионного анализа были включены следующие факторы, которые ассоциировались с наличием ЛР: возраст (OR — odds ratio (отношение шансов) 1,24, 95% доверительный интервал (confidence interval, CI): 1,05-1,47), уровень базальной глюкозы (OR 2,50, 95% CI: 0,73-8,62), уровень растворимых рецепторов лептина (OR 0,65, 95% CI: 0,47- 0,91), курение (OR 0,43, 95% CI: 0,065- 2,89) и радиомический показатель Entropy (OR 2,44, 95% CI: 0,13-46,5). Чувствительность и специфичность модели составляют 90,6 и 57,1%, соответственно.
Заключение. Выявлены значимые факторы, ассоциированные с наличием ЛР у пациентов со стабильной ИБС — радиомический показатель Entropy, старший возраст, высокий уровень базальной глюкозы, курение и низкое содержание растворимых рецепторов к лептину.
Уважаемые читатели, в первом номере журнала обсуждаются ключевые вопросы ведения пациентов, связанные с оценкой риска.
Издательство
- Издательство
- Силицея-Полиграф
- Регион
- Россия, Москва
- Почтовый адрес
- Каширское ш., 24
- Юр. адрес
- Каширское ш., 24
- ФИО
- Боброва Елена Анатольевна (Руководитель)
- Контактный телефон
- +7 (985) 768-43-18