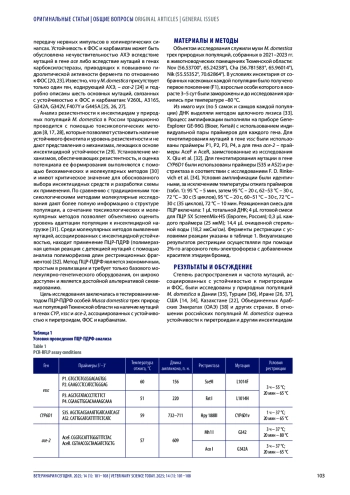
Введение. Значимым фактором в распространении заболеваний животных являются зоофильные мухи, контроль численности которых осложняется проблемой инсектицидной резистентности, актуальной для ветеринарии и медицины во всем мире. Для мониторинга и диагностики устойчивости к инсектицидам в популяциях насекомых все большее применение находят молекулярные методы.
Цель исследования. Оценка распространения основных мутаций, ассоциированных с резистентностью к пиретроидам, фосфорорганическим соединениям и карбаматам, в трех природных популяциях Musca domestica L., собранных в 2021–2023 гг. в животноводческих помещениях Тюменской области.
Материалы и методы. Методом полимеразной цепной реакции с анализом полиморфизма длин рестрикционных фрагментов выполнено генотипирование генов CYP, vssc и ace-2. Результаты. Выявлена одна мутация в гене vssc (L1014F), связанная с устойчивостью к пиретроидам, и две мутации в гене ace-2 (G342A, G342V), обеспечивающие резистентность к фосфорорганическим соединениям и карбаматам. Резистентный аллель L1014F присутствовал у 40–70% исследованных особей всех трех популяций с частотой 30–55%. Аллель G342A обнаружен у 10 и 60% особей двух популяций с частотой 5 и 30% соответственно. Аллель G342V выявлен у 40% особей только одной популяции с частотой 25%.
Заключение. Полученные результаты свидетельствуют о потенциале формирования устойчивости к пиретроидам, фосфорорганическим соединениям и карбаматам в исследованных популяциях Musca domestica, что необходимо учитывать при выборе средств для дезинсекции животноводческих помещений и защиты животных от насекомых. Дальнейшие молекулярные исследования Musca domestica из граничащих с Тюменской областью регионов будут полезны для выработки стратегии по сдерживанию распространения резистентных аллелей в локальных популяциях.
Идентификаторы и классификаторы
- SCI
- Биология
Значимым фактором в распространении различных заболеваний человека и животных являются насекомые [1, 2], включая синантропных и зоофильных мух, к числу которых относится комнатная муха Musca domestica L. (Diptera: Muscidae) [3, 4]. Способность взрослых особей M. domestica быть механическим переносчиком таких патогенов, как яйца гельминтов, простейшие, вирусы и бактерии, в том числе антибиотикорезистентные штаммы, продемонстрирована рядом исследований [4, 5, 6, 7]. Так, бактерии Mannheimia haemolytica, Pasteurella multocida, Histophilus somni, вызывающие респираторные заболевания крупного рогатого скота, были выделены из особей M. domestica, собранных на откормочных площадках, где находились животные с симптомами данных заболеваний [5]. При исследовании гомогенатов, приготовленных из комнатных мух, населявших молочные и мясные фермы США, у выделенных бактерий идентифицировали гены устойчивости к тетрациклинам и флорфениколам с распространенностью от 5 до 95,8% [6]. В лабораторных условиях была показана способность вируса ньюкаслской болезни сохраняться в инфицирующей дозе в кишечнике мух в течение четырех дней после питания зараженным молоком и одного дня – куриным пометом [7], что повышает риск распространения данного заболевания при наличии мух в птицеводческих хозяйствах. Учитывая ветеринарное значение зоофильных мух, необходимо контролировать их численность.
Список литературы
1. Домацкий В. Н., Федорова О. А., Сибен А. Н. Эпизоотологическое и эпидемиологическое значение кровососущих двукрылых насекомых в условиях Крайнего Севера (обзор). Российский паразитологический журнал. 2018; 12 (4): 73-76. DOI: 10.31016/1998-8435-2018-12-4-73-76
2. Давлианидзе Т. А., Еремина О. Ю. Санитарно-эпидемиологическое значение и резистентность к инсектицидам природных популяций комнатной мухи Musca domestica. Вестник защиты растений. 2021; 104 (2): 72-86. DOI: 10.31993/2308-6459-2021-104-2-14984
3. Новак М. Д., Енгашев С. В., Мироненко А. В., Белова Л. М., Енгашева Е. С., Филимонов Д. Н. Динамика численности слепней и зоофильных мух в Центральном районе Российской Федерации. Ветеринария. 2020; (6): 28-32. DOI: 10.30896/0042-4846.2020.23.6.28-32
4. Geden C. J., Nayduch D., Scott J. G., Burgess E. R. IV, Gerry A. C., Kaufman P. E., et al. House fly (Diptera: Muscidae): biology, pest status, current management prospects, and research needs. Journal of Integrated Pest Management. 2021; 12 (1):39. DOI: 10.1093/jipm/pmaa021
5. Neupane S., Nayduch D., Zurek L. House flies (Musca domestica) pose a risk of carriage and transmission of bacterial pathogens associated with bovine respiratory disease (BRD). Insects. 2019; 10 (10):358. DOI: 10.3390/insects10100358
6. Neupane S., Talley J. L., Taylor D. B., Nayduch D. Bacterial communities and prevalence of antibiotic resistance genes carried within house flies (Diptera: Muscidae) associated with beef and dairy cattle farms. Journal of Medical Entomology. 2023; 60 (6): 1388-1397. DOI: 10.1093/jme/tjad112
7. Chakrabarti S., King D. J., Cardona C. J., Gerry A. C. Persistence of exotic Newcastle disease virus (ENDV) in laboratory infected Musca domestica and Fannia canicularis. Avian Diseases. 2008; 52 (3): 375-379. DOI: 10.1637/8173-111407-Reg
8. Давлианидзе Т. А., Еремина О. Ю., Олифер В. В. Резистентность к инсектицидам комнатной мухи Musca domestica в центре Европейской части России. Вестник защиты растений. 2022; 105 (3): 114-121. DOI: 10.31993/2308-6459-2022-105-3-15346
9. Khan H. A. A. Characterization of permethrin resistance in a Musca domestica strain: resistance development, cross-resistance potential and realized heritability. Pest Management Science. 2019; 75 (11): 2969-2974. DOI: 10.1002/ps.5409
10. Abbas N., Hafez A. M. Alpha-cypermethrin resistance in Musca domestica: Resistance instability, realized heritability, risk assessment, and insecticide cross-resistance. Insects. 2023; 14 (3):233. DOI: 10.3390/insects14030233
11. Li Q., Huang J., Yuan J. Status and preliminary mechanism of resistance to insecticides in a field strain of housefly (Musca domestica, L). Revista Brasileira de Entomologia. 2018; 62 (4): 311-314. DOI: 10.1016/j.rbe.2018.09.003
12. Wang J.-N., Hou J., Wu Y.-Y., Guo S., Liu Q.-M., Li T.-Q., Gong Z.-Y. Resistance of house fly, Musca domestica L. (Diptera: Muscidae), to five insecticides in Zhejiang Province, China: The situation in 2017. Canadian Journal of Infectious Diseases and Medical Microbiology. 2019; 2019 (1):4851914. DOI: 10.1155/2019/4851914
13. Ahmadi E., Khajehali J., Rameshgar F. Evaluation of resistance to permethrin, cypermethrin and deltamethrin in different populations of Musca domestica (L.), collected from the Iranian dairy cattle farms. Journal of Asia-Pacific Entomology. 2020; 23 (2): 277-284. DOI: 10.1016/j.aspen.2020.01.014
14. Freeman J. C., Ross D. H., Scott J. G. Insecticide resistance monitoring of house fly populations from the United States. Pesticide Biochemistry and Physiology. 2019; 158: 61-68. DOI: 10.1016/j.pestbp.2019.04.006
15. Hafez A. M. First evaluation of field evolved resistance to commonly used insecticides in house fly populations from Saudi Arabian dairy farms. Insects. 2021; 12 (12):1120. DOI: 10.3390/insects12121120
16. Павлов С. Д., Павлова Р. П., Мавлютов С. М. О резистентности насекомых комплекса гнус и комнатной мухи к действию современных инсектицидов. Энтомологические исследования в Северной Азии: материалы VII Межрегионального совещания энтомологов Сибири и Дальнего Востока в рамках Сибирской зоологической конференции (Новосибирск, 20-24 сентября 2006 г.). Новосибирск: Институт систематики и экологии животных СО РАН; 2006; 416-418.
17. Левченко М. А., Силиванова Е. А., Хлызова Т. А., Бикиняева Р. Х., Метелица И. А. Чувствительность природной популяции Musca domestica (Diptera: Muscidae) к пиретроидным инсектицидам. Российский журнал “Проблемы ветеринарной санитарии, гигиены и экологии”. 2017; (4): 71-75.
18. Ahmadi E., Khajehali J. Dichlorvos resistance in the house fly populations, Musca domestica, of Iranian cattle farms. Journal of Arthropod-Borne Diseases. 2020; 14 (4): 344-352. DOI: 10.18502/jad.v14i4.5271 E
19. Abobakr Y., Al-Hussein F. I., Bayoumi A. E., Alzabib A. A., Al-Sarar A. S. Organophosphate insecticides resistance in field populations of house flies, Musca domestica L.: Levels of resistance and acetylcholinesterase activity. Insects. 2022; 13 (2):192. DOI: 10.3390/insects13020192
20. Еремина О. Ю., Лопатина Ю. В. Молекулярно-генетические механизмы резистентности к инсектицидам у насекомых. Медицинская паразитология и паразитарные болезни. 2017; (4): 44-53.
21. Pan J., Yang C., Liu Y., Gao Q., Li M., Qiu X. Novel cytochrome P450 (CYP6D1) and voltage sensitive sodium channel (Vssc) alleles of the house fly (Musca domestica) and their roles in pyrethroid resistance. Pest Management Science. 2018; 74 (4): 978-986. DOI: 10.1002/ps.4798
22. Qu R., Zhu J., Li M., Jashenko R., Qiu X. Multiple genetic mutations related to insecticide resistance are detected in field Kazakhstani house flies (Muscidae: Diptera). Journal of Medical Entomology. 2021; 58 (6): 2338-2348. DOI: 10.1093/jme/tjab110
23. Li Y., Farnsworth C. A., Coppin C. W., Teese M. G., Liu J.-W., Scott C., et al. Organophosphate and pyrethroid hydrolase activities of mutant Esterases from the cotton bollworm Helicoverpa armigera. PLoS ONE. 2013; 8 (10):e77685. DOI: 10.1371/journal.pone.0077685
24. Kim Y. H., Lee S. H. Which acetylcholinesterase functions as the main catalytic enzyme in the Class Insecta? Insect Biochemistry and Molecular Biology. 2013; 43 (1): 47-53. DOI: 10.1016/jjbmb.2012.11.004
25. Walsh S. B., Dolden T. A., Moores G. D., Kristensen M., Lewis T., Devonshire A. L., Williamson M. S. Identification and characterization of mutations in housefly (Musca domestica) acetylcholinesterase involved in insecticide resistance. Biochemical Journal. 2001; 359 (1): 175-181. :3590175. DOI: 10.1042/0264-6021
26. Adib D., Jafari A., Silivanova E., Basseri H., Gholizadeh S. Molecular analysis of acetylcholinesterase gene in field-collected populations of Musca domestica (Diptera: Muscidae) in Northwestern Iran. Journal of Insect Science. 2023; 23 (4):9. DOI: 10.1093/jisesa/iead054
27. Alzabib A. A., Al-Sarar A. S., Abobakr Y., Saleh A. A. Single and combined mutations of acetylcholinesterase gene giving resistance to pirimi-phos-methyl in Musca domestica slaughterhouse populations. Insects. 2023; 14 (3):218. DOI: 10.3390/insects14030218
28. Левченко М. А., Силиванова Е. А., Шумилова П. А., Сенникова Н. А. Инсектицидная чувствительность и ферментативная активность у Musca domestica L. природных популяций. Российский журнал “Проблемы ветеринарной санитарии, гигиены и экологии”. 2021; (4): 428-435. DOI: 10.36871/vet.san.hyg.ecol.202104008
29. Р 4.2.3676-20 Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности: руководство. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2020. https://docs.cntd.ru/document/573820733.
30. World Health Organization. Manual for monitoring insecticide resistance in mosquito vectors and selecting appropriate interventions. Geneva: World Health Organization; 2022. 65 p. https://www.who.int/publications/i/item/9789240051089.
31. Удалов М. Б., Беньковская Г. В. Популяционная генетика колорадского жука: от генотипа до фенотипа. Вавиловскийжурнал генетики и селекции. 2011; 15 (1): 156-172.
32. Qiu X., Pan J., Li M., Li Y. PCR-RFLP methods for detection of insecticide resistance-associated mutations in the house fly (Musca domestica). Pesticide Biochemistry and Physiology. 2012; 104 (3): 201-205. DOI: 10.1016/j.pestbp.2012.08.002
33. Bender W., Spierer P., Hogness D. S., Chambon P. Chromosomal walking and jumping to isolate DNA from the Ace and rosy loci and the bithorax complex in Drosophila melanogaster. Journal of Molecular Biology. 1983; 168 (1): 17-33. DOI: 10.1016/s0022-2836(83)80320-9
34. Rinkevich F. D., Zhang L., Hamm R. L., Brady S. G., Lazzaro B. P., Scott J. G. Frequencies of the pyrethroid resistance alleles of Vssc1 and CYP6D1 in house flies from the eastern United States. Insect Molecular Biology. 2006; 15 (2): 157-167. https://doi.org/10.1111Zj.1365-2583.2006.00620.x.
35. Huang J., Kristensen M., Qiao C. L., Jespersen J. B. Frequency of kdr gene in house fly field populations: correlation of pyrethroid resistance and kdr frequency. Journal of Economic Entomology. 2004; 97 (3): 1036-1041. DOI: 10.1093/jee/97.3.1036
36. Tafkin V., Bafkurt S., Dogaç E., Tafkin B. G. Frequencies of pyrethroid resistance-associated mutations of Vssc1 and CYP6D1 in field populations of Musca domestica L. in Turkey. Journal of Vector Ecology. 2011; 36 (2): 239-247. DOI: 10.1111/j.1948-7134.2011.00164.x
37. Kamdar S., Farmani M., Akbarzadeh K., Jafari A., Gholizadeh S. Low frequency of knockdown resistance mutations in Musca domestica (Muscidae: Diptera) collected from Northwestern Iran. Journal of Medical Entomology. 2019; 56 (2): 501-505. DOI: 10.1093/jme/tjy177
38. Hamdan M., Kamalanathan T., Iqbal A., Gnanaprakasam A. R., Shajahan S., Alsadeq M. H., et al. kdr mutations and deltamethrin resistance in house flies in Abu Dhabi, UAE. Parasites & Vectors. 2024; 17 (1):47. DOI: 10.1186/s13071-024-06128-5
39. Rinkevich F. D., Du Y., Dong K. Diversity and convergence of sodium channel mutations involved in resistance to pyrethroids. Pesticide Biochemistry and Physiology. 2013; 106 (3): 93-100. DOI: 10.1016/j.pestbp.2013.02.007
40. Hutton S. M., Miarinjara A., Stone N. E., Raharimalala F. N., Raveloson A. O., Rakotobe Harimanana R., et al. Knockdown resistance mutations are common and widely distributed in Xenopsylla cheopis fleas that transmit plague in Madagascar. PLoS Neglected Tropical Diseases. 2023; 17 (8):e0011401. DOI: 10.1371/journal.pntd.0011401
41. Liu N., Li M., Gong Y., Liu F., Li T. Cytochrome P450s - Their expression, regulation, and role in insecticide resistance. Pesticide Biochemistry and Physiology. 2015; 120: 77-81. DOI: 10.1016/j.pestbp.2015.01.006
42. Krestonoshina K., Melnichuk A., Kinareikina A., Maslakova K., Yangirova L., Silivanova E. The P450-monooxygenase activity and CYP6D1 expression in the chlorfenapyr-resistant strain of Musca domestica L. Insects. 2024; 15 (6):461. DOI: 10.3390/insects15060461
43. Chen Z., Newcomb R., Forbes E., McKenzie J., Batterham P. The acetylcholinesterase gene and organophosphorus resistance in the Australian sheep blowfly, Lucilia cuprina. Insect Biochemistry and Molecular Biology. 2001; 31 (8): 805-816. DOI: 10.1016/s0965-1748(00)00186-7 E
44. Mutero A., Pralavorio M., Bride J. M., Fournier D. Resistance-associated point mutations in insecticide-insensitive acetylcholinesterase. Proceedings of the National Academy of Sciences. 1994; 91 (13): 5922-5926. DOI: 10.1073/pnas.91.13.5922
45. Menozzi P., Shi M. A., Lougarre A., Tang Z. H., Fournier D. Mutations of acetylcholinesterase which confer insecticide resistance in Drosophila melanogaster populations. BMC Evolutionary Biology. 2004; 4:4. DOI: 10.1186/1471-2148-4-4
46. Pereira-Castro I., van Asch B., Trindade Rei F., Teixeira Da Costa L. Bactrocera oleae (Diptera: Tephritidae) organophosphate resistance alleles in Iberia: Recent expansion and variable frequencies. European Journal of Entomology. 2015; 112 (1): 20-26. DOI: 10.14411/eje.2015.019
47. Hsu J.-C., Haymer D. S., Wu W.-J., Feng H.-T. Mutations in the acetylcholinesterase gene of Bactrocera dorsalis associated with resistance to organophosphorus insecticides. Insect Biochemistry and Molecular Biology. 2006; 36 (5): 396-402. DOI: 10.1016/jjbmb.2006.02.002
48. Bafkurt S., Tafkin B. G., Dogaç E., Tafkin V. Polymorphism in the acetylcholinesterase gene of Musca domestica L. field populations in Turkey. Journal of Vector Ecology. 2011; 36 (2): 248-257. DOI: 10.1111/j.1948-7134.2011.00165.x
49. Yang X., Mou R., Liang Q., Cheng J., Wu Y., Tan W., Wu J. Frequency and polymorphism of acetylcholinesterase gene involved in the organo-phosphate resistance of Musca domestica in Guizhou Province, China. Archives of Insect Biochemistry and Physiology. 2023; 114 (3):e22045.
Выпуск
Другие статьи выпуска
Введение. В связи с ростом числа заболеваний различной этиологии и развитием антибиотикорезистентности в последние несколько лет возросла значимость такого достижения человечества, как наноматериалы. Cравнительно небольшое количество данных (недостаток данных) о биораспределении, фармакокинетике, а также потенциальной токсичности нанометаллов для организма замедляет разработку более безопасных и эффективных лекарственных средств. Цель исследования. Анализ и обобщение данных современной научной литературы, посвященной изучению наночастиц металлов и наночастиц серебра, их распределения и влияния на организм человека и животных, а также по применению в сфере биомедицины и ветеринарии. Материалы и методы. Поиск источников производился в системах eLIBRARY. RU, cyberleninka. ru, scholar. google. ru, www. mdpi. com, www. researchgate. net, www. sciencedirect. com, базе данных PubMed. Использовалась литература, опубликованная за последние 6 лет, и более ранние исследования.
Результаты. Наноэлементы делят на органические, неорганические и гибридные. Одной из наиболее изученных неорганических наноструктур являются наночастицы металлов. Они находят широкое применение как в инженерии, так и в биомедицине (ветеринарии) в качестве бактерицидного и вирулицидного агента, средств для борьбы с раком, а также в сфере диагностики. На территории СНГ популярными нанометаллами являются наночастицы серебра. Известно, что на антибактериальную активность нанообъектов влияют их форма, размер и поверхностный заряд. Сейчас на фармацевтическом рынке существует несколько видов препаратов серебра, представленные в различных формах: коллоидное (катионное), кластерное и нульвалентное (металлическое) серебро. Препараты нульвалентного серебра наименее токсичные по сравнению с остальными. Лекарства на основе наноразмерных частиц можно вводить оральным, ингаляционным и дермальным способами, а также непосредственно в системный кровоток посредством внутрибрюшинной или внутривенной инъекции. Биораспределение металлических наноструктур зависит от типа частиц, их размера, поверхностного заряда, поверхностного покрытия, связи с белками, а также от путей воздействия, дозы и гидрофобности. Фармакокинетика наночастиц серебра не отличается от распределения наночастиц металлов, при этом наноразмерное серебро способно накапливаться в селезенке, печени, почках и легких, что может вызывать потенциальный токсический эффект.
Заключение. Необходимы дальнейшие углубленные исследования биораспределения, совместимости и потенциальной токсичности наночастиц, которые помогут разработать более эффективные и безопасные лекарственные препараты.
Введение. Современный ареал хламидийной инфекции сельскохозяйственных и диких животных охватывает почти все континенты. В настоящее время для постановки первичного диагноза, проведения скрининговых исследований и отдельных этапов эпизоотологических обследований с целью выявления хламидионосителей в нашей стране применяют «Набор антигенов и сывороток для серологической диагностики хламидиозов сельскохозяйственных животных». При производстве средств диагностики важной задачей является обеспечение стабильности различных компонентов тест-систем в процессе их хранения и транспортировки. Одним из путей решения этой проблемы является стабилизация различных компонентов диагностических препаратов посредством лиофилизации.
Цель исследования. Отработка режима лиофилизации специфической хламидийной сыворотки, оценка ее соответствия характеристикам, заявленным в технических условиях на контроль тест-системы, и испытание стабильности этого компонента.
Материалы и методы. Сыворотку получали из крови овец, иммунизированных эмульсионным вакцинным препаратом штамма «АМК-16» Chlamydia psittaci. До проведения процедуры сублимации гипериммунные сыворотки замораживали до температуры минус 60 °С. Лиофилизацию сывороток проводили на аппарате Scientz 30F (Китай) двумя способами, различающимися температурными режимами и давлением в камере. Готовые препараты сывороток крови оценивали на соответствие техническим условиям диагностического набора. Полученные сублиматы закладывали на хранение на срок 24 мес. и исследовали в реакции связывания комплемента на протяжении этого периода.
Результаты. В ходе проведенных исследований было установлено, что наиболее эффективным оказался способ лиофилизации специфических сывороток, при котором процесс сублимации проходил при более низком давлении и наиболее высокой температуре нагрева. Оценка соответствия полученного препарата характеристикам, заявленным в технических условиях на тест-систему, показала, что качество сыворотки отвечало всем требованиям. Результаты изучения стабильности гипериммунной сыворотки продемонстрировали, что высушенный усовершенствованным способом препарат не теряет своей специфичности на протяжении 24 мес.
Заключение. В результате проведенной работы был отработан оптимальный режим лиофилизации специфической хламидийной сыворотки для диагностической тест-системы. Полученный препарат полностью соответствует характеристикам, заявленным в технических условиях на диагностикум. Установлено, что длительность хранения лиофилизированной сыворотки составляет не менее двух лет, в течение данного периода ее активность и физико-химические свойства не снижаются.
Введение. Воспалительные заболевания молочной железы коров остаются наиболее распространенной проблемой молочного скотоводства, несмотря на оптимизируемые профилактические меры и схемы лечения. Одним из способов предупреждения развития мастита у коров молочного направления продуктивности является генетическая селекция наиболее устойчивых к заболеванию особей. Толл-подобный рецептор 4 (TLR4) играет ключевую роль во врожденном иммунитете, в литературе имеются данные о его значимом влиянии на развитие мастита, описаны ассоциации генетических полиморфизмов гена TLR4 со значениями индекса соматических клеток.
Цель исследования. Определение генетического разнообразия и степени ассоциации с развитием клинического мастита для 3 полиморфных локусов, расположенных в гене TLR4. Материалы и методы. Для достижения поставленной цели использованы данные анамнеза крупного рогатого скота (n = 421), проведена диагностика субклинического мастита при помощи экспресс-теста для определения количества соматических клеток в молоке, при генотипировании крупного рогатого скота по полиморфизмам rs8193046, rs8193060, rs29017188 применена полимеразная цепная реакция в реальном времени по технологии TaqMan.
Результаты. При проведении ассоциативных тестов установлено, что полиморфизмы rs8193046 и rs29017188 являются наиболее перспективными кандидатами для использования в селекционных программах для снижения риска заболеваемости маститом в популяциях Уральского региона. Для rs8193060 отдельно достоверных результатов ассоциативных тестов не выявлено, однако животные с гаплотипом GCG (для аллелей SNP rs8193046, rs8193060, rs29017188) имеют статистически значимый более низкий риск развития мастита.
Заключение. Отмечено, что данные полиморфизмы можно использовать для маркер-ориентированной селекции крупного рогатого скота для профилактики риска развития мастита в популяциях Уральского региона.
Введение. Возбудитель новой коронавирусной инфекции (COVID-19) SARS-CoV-2 получил широкое распространение в мире, став причиной пандемии, которая началась в 2019 г. Вирус является зооантропонозным инфекционным агентом, вызывает инфекцию как у человека, так и у многих видов млекопитающих. К настоящему времени имеются сообщения о выявлении SARS-CoV-2 у домашних животных, а также у представителей дикой фауны. Кроме того, проведены исследования по успешному экспериментальному заражению некоторых видов животных. Имеются также доказательства того, что инфицированные особи могут передавать вирус другим животным в естественных условиях при контакте, в том числе между разными видами. В настоящее время ряд исследователей опасается, что SARS-CoV-2 распространится на виды млекопитающих в дикой природе, которые станут природным резервуаром, что может быть причиной вспышек инфекции в популяции людей. При этом воздействие вируса на потенциально восприимчивые виды животных дикой природы, в том числе исчезающие, в настоящее время до конца не изучено. В связи с этим необходимо проводить исследования по изучению распространения данной инфекции среди животных дикой фауны. Для этого требуются высокочувствительные и специфичные диагностические методы. Иммуноферментный анализ с применением в качестве антигена нуклеокапсидного белка SARS-CoV-2 может быть использован для серологического надзора за новой коронавирусной инфекцией среди животных. Применение в качестве антигена рекомбинантного белка является наиболее предпочтительным с точки зрения безопасности.
Цель исследования. Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2 в высокой концентрации и проверка его антигенной активности и специфичности. Материалы и методы. В работе использовали: SARS-CoV-2, плазмиду pQE, штамм Escherichia coli JM109; осуществляли обратную транскрипцию и полимеразную цепную реакцию, молекулярное клонирование, синтез рекомбинантного белка, очистку рекомбинантного белка, применяли непрямой вариант иммуноферментного анализа.
Результаты. Выполнено молекулярное клонирование N-гена SARS-CoV-2 с использованием прокариотической системы экспрессии. Получены клоны Escherichia coli, продуцирующие рекомбинантный нуклеокапсидный белок SARS-CoV-2 размером 33 кДа. Определены оптимальные условия экспрессии и очистки, обеспечивающие получение препарата антигена в высокой концентрации. Показано, что оптимальной концентрацией индуктора является 0,5 мМ, оптимальный период экспрессии – 4 ч. В результате исследования оптимальных условий очистки рекомбинантного антигена в качестве денатурирующего агента определена мочевина в концентрации 8 М, подобрана оптимальная концентрация имидазола – 0,4 М в элюирующем буфере. Использование оптимальной схемы экспрессии и очистки позволило получить 1,5 мг очищенного антигена с 100 мл культуры Escherichia coli. Показана высокая антигенная активность и специфичность рекомбинантного белка в непрямом варианте иммуноферментного анализа.
Заключение. Получение рекомбинантного нуклеокапсидного белка SARS-CoV-2 в высокой концентрации позволит в перспективе использовать его в качестве антигена при разработке иммуноферментной тест-системы для выявления антител к нуклеокапсидному белку SARS-CoV-2 в сыворотках крови животных.
Введение. Бруцеллез остается одной из наиболее распространенных инфекций в группе особо опасных зоонозов. Устойчивость к патогенным микроорганизмам рода Brucella зависит от полноценного клеточно-опосредованного иммунитета, включающего в себя активацию бактерицидных механизмов фагоцитов. Несмотря на неоднократно доказанную роль нейтрофилов в борьбе со многими бактериальными патогенами, функции этих иммунокомпетентных клеток при бруцеллезе оставались неизученными в течение продолжительного времени.
Цель исследования. Изучение функционально-метаболической активности нейтрофилов у молодняка крупного рогатого скота, сенсибилизированного неагглютиногенным штаммом бруцелл. Материалы и методы. У молодняка крупного рогатого скота, иммунизированного против бруцеллеза вакциной из неагглютиногенного штамма Brucella abortus RB-51, оценивали функционально-метаболическое состояние нейтрофилов на 7, 14, 21, 28, 35-е сут после иммунизации в тесте с нитросиним тетразолием, а также по уровню ферментной активности миелопероксидазы и содержанию неферментных катионных белков. Измерения показателей проводили фотометрическим способом в спонтанном и стимулированном вариантах постановки с последующим расчетом коэффициентов стимуляции. В качестве стимуляторов реакции применяли дезинтеграты бруцелл и корпускулярные антигены, изготовленные из вакцинных штаммов бруцелл с разной антигенной структурой.
Результаты. Было установлено, что при иммунизации молодняка крупного рогатого скота неагглютиногенным штаммом бруцелл функционально-метаболический статус нейтрофилов характеризуется усилением активности нейтрофилов в тесте с нитросиним тетразолием на 7-е и 35-е сут исследования, отсутствием выраженных изменений в показателях ферментной активности миелопероксидазы, а также снижением количества неферментных катионных белков на 7–14-е сут после вакцинации.
Заключение. Наиболее выраженное увеличение коэффициентов стимуляции отмечается при применении в качестве стимулятора реакции дезинтегратов бруцелл. При оценке кислородзависимого метаболизма нейтрофилов в тесте с нитросиним тетразолием максимальные значения коэффициентов стимуляции отмечали на 28-е сут после вакцинации, при оценке кислороднезависимого метаболизма – на 14-е сут.
Введение. Респираторный микоплазмоз и инфекционный синовит птиц являются экономически значимыми и нотифицируемыми болезнями, поэтому вопрос борьбы с Mycoplasma gallisepticum и Mycoplasma synoviae на птицеводческих предприятиях является актуальным. Применение вакцин – один из способов специфической профилактики, однако при разработке препаратов особое внимание уделяется оценке их протективных свойств. Контрольное заражение не всегда приводит к проявлению болезни ввиду ее преимущественно хронического течения и факторности.
Цель исследования. Воссоздание факторов, способствующих проявлению болезни в лабораторных условиях, и выявление патологических изменений в организме зараженных и иммунизированных птиц на гистологическом уровне. Материалы и методы. В качестве подопытных животных были отобраны серонегативные и вакцинированные куры кросса Хайсекс белый в возрасте 67 сут. В ходе опыта использовали штамм S6 Mycoplasma gallisepticum, штамм WVU 1853 Mycoplasma synoviae и штамм А/chicken/Amursky/03/12/Н9N2 вируса низкопатогенного гриппа птиц.
Результаты. Ассоциированное течение микоплазмозов с низкопатогенным гриппом птиц проявляется заболеванием и патогистологическими изменениями, среди которых легкие респираторные расстройства и суставной синдром. При гистологическом исследовании у зараженных невакцинированных птиц выявили нарушение целостности реснитчатого эпителия трахеи с очагами десквамации. У вакцинированной против микоплазмоза и экспериментально инфицированной птицы признаков отслаивания эпителия не наблюдалось, однако выявляли локальный отек подслизистого слоя трахеи. В железе третьего века у невакцинированных птиц, зараженных вирусом низкопатогенного гриппа птиц Н9N2, Mycoplasma gallisepticum и Mycoplasma synoviae, отмечали дистрофические изменения и инфильтрацию лимфоцитами, что свидетельствовало о наличии воспаления. В группе как вакцинированных, так и невакцинированных экспериментально инфицированных птиц в тканях легких выявляли лимфоцитарную инфильтрацию. Во всех группах птиц, кроме контрольной, наблюдали картину депопуляции лимфоцитов в корковом веществе фабрициевой сумки.
Заключение. Результатом данного исследования является создание метода проведения контрольного заражения птиц Mycoplasma gallisepticum и Mycoplasma synoviae, а также выявление условий для клинического проявления микоплазмозов, установление патологических изменений на клеточном уровне вследствие инфицирования.
Введение. Вакцинопрофилактика высокопатогенного гриппа птиц является надежным способом борьбы с болезнью. Среди антигриппозных вакцин наиболее широкое распространение имеют инактивированные цельновирионные препараты. Изучение иммуногенной активности вакцины «ВНИИЗЖ-АвиФлуВак» против актуальных вирусов высокопатогенного гриппа птиц является важной задачей.
Цель исследования. Оценка иммуногенной активности инактивированной вакцины «ВНИИЗЖ-АвиФлуВак» против актуального для России в 2023 г. высокопатогенного вируса гриппа птиц подтипа H5N1. Материалы и методы. Для испытаний готовили 4 вакцинных образца, содержащих цельный и разведенный 1/25, 1/50 и 1/100 антиген вируса гриппа птиц Н5 в прививном объеме. Каждым препаратом была привита отдельная группа птиц 4-недельного возраста. Через 28 сут куры были заражены вирусом гриппа птиц A/gull/Kirov/998-1/2023 H5N1, который был выделен во время вспышки заболевания на территории Российской Федерации и филогенетически определен как высокопатогенный возбудитель, принадлежащий к азиатской генетической линии вируса высокопатогенного гриппа птиц подтипа H5 (клада 2.3.4.4b). В группах зараженных птиц в течение 6 дней регистрировали погибших и больных особей.
Результаты. Установили, что птицы, привитые цельной дозой антигена, были полностью защищены от клинического проявления болезни после контрольного заражения. Уменьшение концентрации антигена в прививном объеме обусловило снижение протективной защиты вакцины. Показатель смертности после заражения контрольных (интактных) цыплят составил 10/10. Анализ зависимости протективной активности вакцины от величины иммунизирующей дозы антигена показал, что одна прививная доза содержала 97 ПД50. Исследование связи протективной защиты и напряженности поствакцинального гуморального иммунитета позволило определить, что ожидаемый среднегрупповой титр антител, который соответствует защите 90% вакцинированных птиц, составил 5,7 log2, или ≈ 1:52.
Заключение. Вакцина «ВНИИЗЖ-АвиФлуВак» обладает высокой иммуногенной активностью против актуального для России в 2023 г. вируса высокопатогенного гриппа птиц подтипа H5N1.
Введение. Высокопатогенный грипп птиц является особо опасной высококонтагиозной вирусной инфекцией домашних и диких птиц, в последние годы получившей широкое распространение на территории стран Европы, Азии, Африки и Америки. Возбудитель заболевания – вирус гриппа типа А подтипов H5 и H7. Одним из наиболее быстрых и эффективных способов идентификации и типирования вируса гриппа птиц является ОТ-ПЦР в режиме реального времени, в связи с чем представляется актуальной разработка тест-системы на основе данного метода с использованием внутреннего контрольного образца для возможности контроля основных этапов проведения реакции. При этом постановка реакции в мультиплексном формате позволяет одновременно идентифицировать несколько целевых мишеней, что уменьшает расход реагентов и время постановки реакции.
Цель исследования. Разработка тест-системы для выявления в пробах биологического материала РНК вируса гриппа птиц подтипов H5 и H7 методом мультиплексной ОТ-ПЦР в режиме реального времени и определение ее основных характеристик. Материалы и методы. Использовали изоляты вируса гриппа птиц подтипов H5, H7, H3, H4, H10, H16, вирусы ньюкаслской болезни, инфекционной бурсальной болезни, инфекционного бронхита кур, болезни Марека и аденовирус птиц. В качестве внутреннего контрольного образца служил бактериофаг MS2.
Результаты. Подобраны оптимальные сочетания систем праймеров и зондов, определены характеристики тест-системы: специфичность в отношении гомологичных и гетерологичных вирусов болезней птиц, аналитическая чувствительность, эффективность реакции амплификации, повторяемость и воспроизводимость.
Заключение. При определении валидационных характеристик разработанной тест-системы установлена ее специфичность в отношении только вируса гриппа птиц подтипов H5 и H7, аналитическая чувствительность для каждого подтипа составила 1,5 lg ЭИД50/см3, эффективность амплификации – 92 и 97% соответственно. Проведена апробация тест-системы при исследовании поступающих в лабораторию проб биологического материала, результаты соответствовали таковым для стандартных диагностических методов, используемых в референтной лаборатории вирусных болезней птиц ФГБУ «ВНИИЗЖ».
Введение. Свиноводство, как скороспелая отрасль животноводства, способно в короткие сроки добиться существенного увеличения производства свинины с высокими пищевыми свойствами и биологической полноценностью. Одной из острых проблем отрасли являются респираторные болезни вирусно-бактериальной этиологии. В сложившихся экономических условиях особое значение приобретает снижение технологической импортозависимости российского свиноводства, поэтому выпуск кормовых и ветеринарных препаратов отечественного производства необходимо рассматривать как важнейшее условие достижения технологического суверенитета Российской Федерации.
Цель исследования. Анализ обеспеченности свиноводства отечественными вакцинами против таких значимых респираторных болезней свиней, как грипп, энзоотическая (микоплазменная) пневмония, репродуктивно-респираторный синдром, цирковирусная инфекция, а также выявление факторов, которые препятствуют разработке иммунобиологических лекарственных препаратов против указанных заболеваний.
Материалы и методы. Информационной базой исследований являлись данные свиноводческих организаций Российской Федерации, государственный реестр лекарственных средств для ветеринарного применения Россельхознадзора, нормативно-справочная и специальная литература, публикации научно-исследовательских учреждений.
Результаты. Возбудители гриппа, энзоотической (микоплазменной) пневмонии, репродуктивно-респираторного синдрома, цирковирусной инфекции являются наиболее распространенными патогенами, которые вызывают респираторные болезни свиней на свиноводческих комплексах. На протяжении последних лет российские биофабрики разрабатывают программы импортозамещения необходимых иммунобиологических лекарственных препаратов. По итогам 2023 г. отечественные предприятия выпустили 19,3 млрд доз вакцин для ветеринарного применения, что на 3 млрд доз больше по сравнению с 2022 г.
Заключение. Вакцинация является наиболее эффективным и экономичным способом профилактики вирусных инфекций. Однако отечественные иммунологические лекарственные препараты против гриппа свиней еще не разработаны в нашей стране, а вакцины против энзоотической (микоплазменной) пневмонии, репродуктивно-респираторного синдрома, цирковирусной инфекции свиней требуют доработки в связи с высокой изменчивостью возбудителей.
Введение. Заразный узелковый дерматит крупного рогатого скота, также известный как нодулярный дерматит, на данный момент представляет собой актуальную проблему ветеринарии вследствие значительного экономического ущерба, причиняемого животноводческой отрасли. Риск распространения заразного узелкового дерматита крупного рогатого скота и проникновения его в благополучные по заболеванию страны с каждым годом увеличивается. В связи с этим актуальным вопросом становится своевременное отслеживание распространения инфекции для выработки стратегии борьбы с ней. В представленном обзоре рассмотрены особенности проявления и течения заболевания, оцениваются исторические и статистические данные по распространению заразного узелкового дерматита крупного рогатого скота в странах Ближнего Востока и будущие направления совместных действий на международном уровне.
Цель исследования. Анализ исторических и статистических данных проявления заразного узелкового дерматита у крупного рогатого скота в странах Ближнего Востока. Материалы и методы. Сбор теоретического материала проводился в электронных библиотеках с использованием ресурсов: PubMed, Web of Science, eLIBRARY. RU, mdpi. com, frontiersin. org, researchgate. net и др. Проанализированы англоязычные литературные данные за последние 10 лет.
Результаты. После выхода вируса заразного узелкового дерматита крупного рогатого скота за границы Африканского континента в 1988 г. он ненадолго задержался в пределах стран Ближнего Востока, уже через два года проникнув далее на запад и восток. Несмотря на дальнейшее распространение, в ближневосточных странах еще в течение нескольких последующих лет отмечались повторные вспышки заболевания. Многие страны Ближнего Востока все еще сталкиваются с проблемой бесконтрольного перемещения скота, отсутствием возможностей для проведения качественной лабораторной диагностики, нерегулярностью контактов с международными организациями в сфере здравоохранения и надзора, усугубляемыми нестабильностью политической ситуации в регионе. Данные проблемы подчеркивают важность борьбы с заразным узелковым дерматитом крупного рогатого скота на международном уровне, значение регионального и международного сотрудничества и проведения эффективной политики биобезопасности.
Заключение. Определена роль Ближневосточного региона в распространении возбудителя болезни, названы вероятные причины неблагополучия региона по данному заболеванию, сформулировано направление дальнейших действий в рамках борьбы с заразным узелковым дерматитом крупного рогатого скота.
Введение. Одной из самых распространенных групп патологий, встречающихся у молодняка крупного рогатого скота, являются болезни желудочно-кишечного тракта. Частой их причиной являются возбудители инфекций, среди которых преобладающее значение имеют ротавирус, коронавирус и патогенная форма кишечной палочки.
Цель исследования. Анализ и систематизация актуальной информации о роли рота-, коронавируса и патогенных штаммов Escherichia coli в этиологии болезней крупного рогатого скота, в том числе молодняка, сведений о заболеваемости этими инфекциями на территории Российской Федерации и других стран мира, а также актуальности вакцинопрофилактики против вышеназванных патогенов.
Результаты. В статье представлена информация о строении ротавируса, коронавируса и Escherichia coli, биологических свойствах возбудителей, факторах, влияющих на форму и тяжесть течения болезней. На основании анализа научной литературы отечественных и зарубежных авторов представлены данные о распространенности колибактериоза, ротавирусной и коронавирусной инфекций, а также описаны основные методы их контроля. Подтверждена важность вакцин для профилактики указанных болезней, перечислены факторы, влияющие на эффективность вакцинопрофилактики, и приведены меры ее повышения.
Заключение. Средний уровень заболеваемости ротавирусной инфекцией в мире составляет 32,7%, коронавирусной инфекцией – 18,4%, колибактериозом – 39,1%. В России показатель превалентности вышеупомянутых болезней равен 41,4; 33,1 и 30,2% соответственно. Таким образом, в Российской Федерации уровень заболеваемости рота- и коронавирусной инфекциями крупного рогатого скота превышает средний показатель в мире на 8,7 и 14,7% соответственно. Эпизоотическая ситуация по колибактериозу в России благополучнее, чем в большинстве стран: болезнь регистрируется реже среднего мирового значения на 8,9%. Большое генетическое разнообразие и распространенность вышеупомянутых возбудителей требуют комплексного подхода для борьбы с ними. Одним из наиболее эффективных способов является вакцинопрофилактика, что делает разработку эффективных и безопасных вакцинных препаратов против ротавирусной, коронавирусной инфекций и эшерихиоза актуальной задачей.
Введение. Высокопатогенный грипп птиц в настоящее время требует самого пристального внимания всего международного сообщества. Определение факторов, влияющих на передачу и репликацию вируса гриппа птиц у млекопитающих, а также анализ происходящих эволюционных процессов позволит предположить, какие вирусные линии будут иметь потенциал к преодолению видового барьера и инфицированию нетипичных хозяев, в том числе людей.
Цель исследования. Изучение эпизоотической ситуации по гриппу птиц среди млекопитающих, описание особенностей эпизоотического процесса при гриппе птиц, ретроспективный анализ вспышек гриппа у нетипичных хозяев. Материалы и методы. Работу выполняли в информационно-аналитическом центре Управления ветнадзора при ФГБУ «Федеральный центр охраны здоровья животных» (г. Владимир). Сбор сведений осуществляли на основе статистического материала базы данных Всемирной организации здравоохранения животных WAHIS и научных публикаций зарубежных и отечественных авторов. Картографический анализ проводили с помощью географической информационной системы ArcGIS (ESRI, США).
Результаты. С 2022 по 2024 г. в эпизоотический процесс, вызванный вирусом гриппа подтипа H5N1, были вовлечены млекопитающие различных семейств, у представителей которых ранее болезнь не регистрировали: полорогие, куницеобразные, медвежьи и др. Для эффективного предотвращения распространения заболевания важны строгие меры биобезопасности и актуализация систем оповещения. В ограниченном числе стран (Бангладеш, Доминиканская Республика, Китай, Египет, Индонезия, Лаос, Вьетнам, страны Евросоюза и др.) в качестве профилактической экстренной меры для защиты птиц от гриппа использовали вакцинацию.
Заключение. Передача вируса высокопатогенного гриппа птиц млекопитающим разных видов, в том числе сельскохозяйственным животным, может дать старт будущей пандемии. Межвидовая передача вируса, регистрируемая в последнее время, указывает на возникновение адаптивных мутаций и представляет собой угрозу здоровью животных, общественному здравоохранению, продовольственной безопасности и биоразнообразию.
Издательство
- Издательство
- ФГБУ «ВНИИЗЖ»
- Регион
- Россия, Владимир
- Почтовый адрес
- Россия, 600901, г. Владимир, мкр. Юрьевец
- Юр. адрес
- 600901, ВЛАДИМИРСКАЯ ОБЛАСТЬ, Г. ВЛАДИМИР, МКР ЮРЬЕВЕЦ, МКР. ЮРЬЕВЕЦ
- ФИО
- Рыбин Роман Николаевич (Руководитель)
- E-mail адрес
- arriah@fsvps.gov.ru
- Контактный телефон
- +7 (903) 8991501
- Сайт
- https://arriah.ru