Введение. Предстательная железа – одна из самых частых локализаций у мужчин среди всех онкологических заболеваний. Гистологическая классификация рака предстательной железы основана на шкале Глисона и часто ограничена субъективным решением и практическим опытом врача-патологоанатома. Программы, основанные на искусственном интеллекте, способны преодолеть данный недостаток и имеют потенциал исследования и использования в клинической практике. Цель исследования – разработать интеллектуальную автоматизированную систему на основе глубокого обучения с целью морфологической диагностики рака предстательной железы с дифференциацией по шкале Глисона.
Материалы и методы. Материалом исследования послужили биоптаты предстательной железы 200 пациентов с подозрением на рак. 882 готовых гистологических препарата оцифровывались на автоматическом сканере с последующим созданием полнослайдовых изображений. Полученные тяжеловесные фотографии формата TIFF конвертировались в приемлемый для работы в аннотаторе формат JPEG. Аннотирование проводилось с помощью веб-инструмента MakeSense. AI. По результатам работы последнего подготавливались наборы данных для обучения моделей первичной и вторичной классификации, а также сегментации.
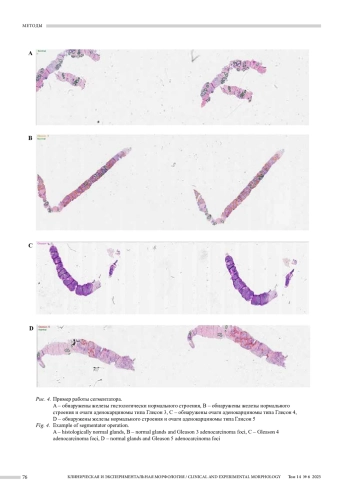
Результаты. Мера производительности вторичного классификатора, определяющего, присутствуют ли на микрофотографии комплексы рака, без указания их локализации и конкретной степени дифференцировки, составила 0,965. Аналогичный показатель работы сегментатора, выделяющего контуры железистых структур и уточняющего степень их дифференцировки по шкале Глисона, составил в среднем 0,798.
Заключение. Качественная работа сегментатора требует большего объема данных и дальнейшего обучения нейросети, однако результаты подтверждают, что алгоритм искусственного интеллекта имеет высокий потенциал для улучшения качества морфологической диагностики.
Идентификаторы и классификаторы
Рак предстательной железы (РПЖ) является второй по частоте причиной смерти у мужчин среди всех онкологических заболеваний. РПЖ классифицируется по шкале Глисона, установленной Дональдом Глисоном в 1966 году. Данная система хотя и пересматривалась в 2005 и 2014 годах, признана Всемирной организацией здравоохранения как один из важнейших инструментов в прогнозировании заболевания и выборе тактики лечения. Шкала Глисона ориентируется на морфологическую структуру опухоли и включает в себя пять градаций, где 1 означает высокую дифференцировку, а 5 – низкую. Оценка 1–3 по Глисону обозначает хорошо разделенные тубулярные железы, отличающиеся от нормальных отсутствием базального слоя миоэпителия, оценка 4 по Глисону подразумевает криброзные и гломерулоидные варианты, а также микрожелезистые структуры, оценка 5 – отдельные опухолевые клетки, солидные и скиррозные структуры, а также комедонекрозы [1].
Список литературы
1. Epstein JI, Amin MB, Reuter VE, Humphrey PA. Contemporary Gleason grading of prostatic carcinoma: an update with discussion on practical issues to implement the 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol. 2017;41(4):e1-e7. DOI: 10.1097/PAS.0000000000000820.
2. Hunter B, Hindocha S, Lee RW. The role of artificial intelligence in early cancer diagnosis. Cancers (Basel). 2022;14(6):1524. DOI: 10.3390/cancers14061524.
3. Заридзе Д.Г. Перспективы применения искусственного интеллекта для повышения эффективности скрининга злокачественных новообразований. Общественное здоровье. 2024;4(4):24-42. DOI: 10.21045/2782-1676-2024-4-4-24-42.
Zaridze DG. Prospects of using artificial intelligence for improving cancer screening efficacy. Public Health. 2024;4(4):24-42 (In Russ.). DOI: 10.21045/2782-1676-2024-4-4-24-42.
4. Бузаев И.В., Плечев В.В., Галимова Р.М., Киреев А.Р., Юлдыбаев Л.Х., Шайхулова А.Ф. и др. Развитие технологий искусственного интеллекта в онкологии и лучевой диагностике. Креативная хирургия и онкология. 2018;8(3):208-215. DOI: 10.24060/2076-3093-2018-8-3-208-215.
Buzaev IV, Plechev VV, Galimova RM, Kireev AR, Yuldybaev LK, Shaykhulova AF et al. Artificial intelligence developments in medical visualization and oncology. Creative surgery and oncology. 2018;8(3):208-215 (In Russ.). DOI: 10.24060/20763093-2018-8-3-208-215.
5. Волкова Л.В., Батищев А.В., Михалева Л.М. Исследование патологии желудка с использованием методов искусственного интеллекта для анализа данных микроскопии. Клиническая и экспериментальная морфология. 2024;13(3):5-15. DOI: 10.31088/CEM2024.13.3.5-15.
Volkova LV, Batishchev AV, Mikhaleva LM. Studying gastric pathologies using artificial intelligence to analyze microscopy data. Clinical and experimental morphology. 2024;13(3): 5-15 (In Russ.). DOI: 10.31088/CEM2024.13.3.5-15.
6. Mosch L, Furstenau D, Brandt J, Wagnitz J, Klopfenstein SA, Poncette AS et al. The medical profession transformed by artificial intelligence: qualitative study. Digit Health. 2022;8:20552076221143903. DOI: 10.1177/2055207 6221143903.
7. Попов Г.В., Чуб А.А., Лернер Ю.В., Цой Л.В., Дубинина А.В., Варшавский В.А. Искусственный интеллект в диагностике рака предстательной железы. Архив патологии. 2021;83(2):38-45. DOI: 10.17116/patol20218302138.
Popov GV, Chub AA, Lerner YuV, Tsoy LV, Dubinina AV, Varshavsky VA. Artificial intelligence in the diagnosis of prostate cancer. Archive of Pathology = Arkhiv patologii. 2021;83(2):38-45 (In Russ.). DOI: 10.17116/patol20218302138.
8. Nguyen TH, Sridharan S, Macias V, Kajdacsy-Balla A, Melamed J, Do MN et al. Automatic Gleason grading of prostate cancer using quantitative phase imaging and machine learning. J Biomed Opt. 2017;22(3):36015. DOI: 10.1117/1.JBO.22.3.036015.
9. Morozov A, Taratkin M, Bazarkin A, Rivas JG, Puliatti S, Checcucci E et al. A systematic review and meta-analysis of artificial intelligence diagnostic accuracy in prostate cancer histology identification and grading. Prostate Cancer Prostatic Dis. 2023;26(4):681-92. DOI: 10.1038/s41391-023-00673-3.
10. Busby D, Grauer R, Pandav K, Khosla A, Jain P, Menon M et al. Applications of artificial intelligence in prostate cancer histopathology. Urol Oncol. 2024;42(3):37-47. DOI: 10.1016/j. urolonc.2022.12.002.
11. Васильев А.О., Говоров А.В., Ким Ю.А., Арутюнян П.А., Пушкарь Д.Ю. Искусственный интеллект в ранней диагностике рака предстательной железы. Экспериментальная и клиническая урология. 2025;18(1):42-49. DOI: 10.29188/22228543-2025-18-1-42-49.
Vasilyev AO, Govorov AV, Kim YuA, Arutyunyan PA, Pushkar DYu. Artificial intelligence in early diagnosis of prostate cancer. Experimental and Clinical Urology. 2025;18(1):42-49 (In Russ.). DOI: 10.29188/2222-8543-2025-18-1-42-49.
12. Морозов А.О., Базаркин А.К., Вовденко С.В., Тараткин М.С., Балашова М.С., Еникеев Д.В. Применение искусственного интеллекта в молекулярной и генетической диагностике рака простаты. Вестник урологии. 2024;12(1):117-130. DOI: 10.21886/2308-6424-2024-12-1-117-130.
Morozov AO, Bazarkin AK, Vovdenko SV, Taratkin MS, Balashova MS, Enikeev DV. Artificial intelligence in molecular and genomic prostate cancer diagnostics. Urology Herald. 2024;12(1): 117-130 (In Russ.). DOI: 10.21886/2308-6424-202412-1-117-130.
13. Bulten W, Kartasalo K, Chen PC, Strom P, Pinckaers H, Nagpal K et al. Artificial intelligence for diagnosis and Gleason grading of prostate cancer: the PANDA challenge. Nat Med. 2022;28(1):154-63. DOI: 10.1038/s41591-021-01620-2.
Выпуск
Другие статьи выпуска
Первичные доброкачественные и злокачественные меланоцитарные опухоли центральной нервной системы относятся к крайне редким заболеваниям. Злокачественная меланоцитарная опухоль мягких мозговых оболочек с диффузным характером роста – первичный диффузный менингеальный меланоматоз – является высокоагрессивным новообразованием с абсолютно неблагоприятным прогнозом, для которой до сих пор не разработаны стандарты лечения. Она чрезвычайно трудна для диагностики ввиду разнообразной клинической картины, отсутствия специфических изменений при нейровизуализации и нередких ложноотрицательных результатов цитологического исследования ликвора и биопсий.
Представлен случай первичного диффузного менингеального меланоматоза у молодого мужчины с быстро прогрессирующим течением и летальным исходом спустя 2,5 месяца от момента появления первых клинических симптомов. Диагноз был установлен посмертно при аутопсии.
Буллезный пемфигоид является наиболее распространенным аутоиммунным буллезным дерматозом, для которого, с одной стороны, характерна ассоциация с целым рядом заболеваний, в том числе с псориазом. С другой стороны, буллезный пемфигоид может быть индуцирован различными лекарственными препаратами, такими как глиптины, сульфаниламиды и т. д. В статье представлен случай манифестации буллезного пемфигоида на фоне псориаза после введения метотрексата, показаны морфологические особенности данного сочетания, а также продемонстрирована важность метода иммунофлуоресценции в диагностике буллезного пемфигоида.
Нормальная анатомия грудной железы у мужчин, как и ее патологическая анатомия, недостаточно описана. Рак грудной железы является редкой патологией и представляет большой интерес не только для патологоанатомов, но и для врачей-генетиков, клиницистов. Ввиду нечастой встречаемости данной нозологии в литературе представлены немногочисленные исследования, описывающие в основном клинико-лабораторные аспекты. Работы, посвященные патоморфологическому исследованию ткани пораженной грудной железы у мужчин, единичны. В статье описывается наблюдение рака грудной железы, выявленное впервые при аутопсии, у умершего пациента-долгожителя.
Введение. В современном мире продолжает увеличиваться число беременностей, протекающих на фоне вторичных иммунодефицитных состояний, вызванных как внутренними, так и внешними факторами, такими как инфекционные процессы, травмы, тяжелые операции и развитие опухолей. Недостаток знаний о воздействии различных иммунокомпрометирующих факторов до беременности на развитие иммунных органов ставит задачи по дальнейшему поиску новых данных. Цель исследования – оценить морфологическую структуру селезенки и пролиферативную активность ее клеток у потомства иммунокомпрометированных крыс-самок в условиях экспериментально смоделированного онкогенеза.
Материалы и методы. С помощью классических морфологических подходов (окрашивание гематоксилином и эозином) и специфического иммуногистохимического маркера пролиферации Ki67 проведено исследование селезенки 150 крыс – потомства интактных и иммунокомпрометированных особей без воздействия и в условиях постнатального введения канцерогена 1,2-диметилгидразина. В качестве иммунокомпрометирующего фактора была выбрана спленэктомия, которую проводили крысам-самкам за 1 месяц до зачатия.
Результаты. У потомства иммунокомпрометированных крыс-самок значительно сокращается доля структур селезенки, относящихся к ее белой пульпе, – в 1,75 раза (p<0,01), при этом количество лимфоидных узелков больших размеров уменьшается на 8,05% (p<0,01). На фоне роста опухоли в толстой кишке у потомства крыс-самок, перенесших спленэктомию, гипоплазия белой пульпы селезенки более выражена, чем у потомства крыс, чья беременность протекала без особенностей. Также при развитии аденокарциномы у потомства иммунокомпрометированных крыс в селезенке более значимо уменьшается численность Ki67+ клеток, в первую очередь в герминативных центрах лимфоидных узелков.
Заключение. У потомства крыс, чья беременность протекала на фоне иммунокомпрометированного состояния, наблюдаются гипопластические изменения в белой пульпе селезенки. При онкогенезе у такого потомства происходит более выраженное сокращение интенсивности клеточной пролиферации с одновременным уменьшением количества вторичных лимфоидных узелков и площади белой пульпы, что может быть одним из признаков иммунодефицитного состояния, которое в дальнейшем приводит к прогрессированию опухоли.
Введение. Межклеточное вещество культивируемых клеток представляет значительный интерес для исследователей, поскольку имеет ряд преимуществ перед децеллюляризированным межклеточным веществом тканей. In vitro возможно направленно модифицировать свойства продуцируемого межклеточного вещества за счет контролируемого изменения условий культивирования, что делает его универсальным материалом для использования в физиологических исследованиях и протоколах регенеративной медицины. Характеристика структур межклеточного вещества необходима для создания протоколов оценки качества и определения функциональных свойств получаемых бесклеточных конструктов. Цель данной работы – охарактеризовать структурные особенности фибриллярных компонентов межклеточного вещества мультипотентных мезенхимальных стромальных клеток пупочного канатика человека на разных сроках культивирования.
Материалы и методы. Клетки культивировали в присутствии 2-фоcфо-L-аcкорбата натрия для продукции межклеточного вещества в течение 5, 7 и 10 суток. После удаления клеток фазово-контрастные фибриллярные структуры, а также окрашенные пикросириусом красным коллагеновые волокна исследовали с помощью фазово-контрастной и светлопольной микроскопии. Для морфометрии образцов межклеточного вещества использовали программы анализа изображения ImageJ и Matlab.
Результаты. Морфометрический анализ фазово-контрастных фибриллярных структур межклеточного вещества, а также коллагеновых волокон от мезенхимальных стромальных клеток на разных сроках показал, что длительность культивирования не влияла на геометрические параметры волокон (средний размер, общая длина и площадь). Оценка параметров сложности структуры выявила изменение микроархитектоники коллагенового каркаса за счет снижения лакунарности и увеличения изотропности.
Заключение. При увеличении длительности культивирования мезенхимальных стромальных клеток происходит ремоделирование коллагенового каркаса, приводящее к более упорядоченному изотропному распределению коллагеновых волокон. Соответственно, время созревания межклеточного вещества может быть использовано как фактор направленной модификации его свойств, что востребовано в исследованиях механизмов его участия в регуляции свойств клеток, а также в регенеративной медицине для создания тканеинженерных конструктов.
Введение. Одним из прогностически неблагоприятных подтипов острых миелоидных лейкозов является лейкоз с реаранжировками гена KMT2A. Характерной особенностью данного подтипа лейкозов считается высокая гетерогенность. Также перестройка гена KMT2A – генетическое событие, достаточное для развития лейкоза, что служит основой для разработки таргетных подходов к лечению. Цель исследования – охарактеризовать морфологические особенности острых миелоидных лейкозов с реаранжировками гена KMT2A у взрослых пациентов.
Материалы и методы. Материалом для исследования послужили аспираты костного мозга (n=121), полученные при толстоигольной биопсии грудины у взрослых пациентов с впервые выявленными острыми миелоидными лейкозами. В ходе работы применены цитологические, цитохимические, иммунофенотипические, цитогенетические и молекулярно-генетические методы. Детекция специфических для острых миелодных лейкозов транскриптов химерных генов проведена при помощи полимеразной цепной реакции. Полученные результаты обработаны статистически.
Результаты. Частота острых миелоидных лейкозов с реаранжировками KMT2A в исследуемой группе равнялась 4,1%. Возраст пациентов составлял от 42 до 71 года, уровень лейкоцитов в периферической крови – от 1480 до 100 690 в 1 мкл, бластемия – от 0 до 96%, уровень бластов в костном мозге – от 26,8 до 93,8%, что подтверждает значительную гетерогенность KMT2A+ лейкозов. Молекулярно-генетические варианты мутаций включали три типа химерных транскриптов KMT2A с разными генами-партнерами и один неспецифицированный вариант. Несмотря на ограниченный объем выборки, была выявлена статистически достоверная кластеризация KMT2A+ острых миелоидных лейкозов с иммунофенотипом CD56+, NG2+, а также в подгруппе с минимальной дифференцировкой. Во всех случаях течение KMT2A-ассоциированных лейкозов завершилось летальным исходом в сроки, не превышающие 10 месяцев от начала заболевания.
Заключение. Таким образом, KMT2A+ острые миелоидные лейкозы у взрослых характеризуются неблагоприятным клиническим прогнозом, что обусловливает необходимость их дальнейшей дифференциации для разработки лечебных стратегий, учитывающих клеточное происхождение и генотип-фенотипические ассоциации на основе технологий молекулярного профилирования.
Введение. Известно, что в развитии ремоделирования миокарда при многих сердечно-сосудистых заболеваниях важную роль играют тучные клетки, однако их вклад в формирование миокардиального фиброза при артериальной гипертензии, осложненной гипертонической нефропатией, остается мало изученным.
Цель работы – исследовать морфофункциональные особенности тучных клеток в миокарде у пациентов с гипертонической нефропатией.
Материалы и методы. Проведен гистологический и морфометрический анализ образцов ткани миокарда, полученных в ходе аутопсии от пациентов с гипертонической нефропатией и без данной патологии. Изучению подлежали такие параметры как количество тучных клеток, их площадь и индекс дегрануляции. Дополнительно рассчитывалась площадь фиброза миокарда. Для оценки непараметрических показателей определяли медиану и интерквартильный интервал (25-й и 75-й процентили). Для сравнения двух независимых выборок использовали непараметрический U-критерий Манна–Уитни. Для выявления корреляционной связи между различными признаками был использован метод ранговой корреляции Спирмена.
Результаты. В миокарде пациентов с гипертонической нефропатией в сопоставлении с группой сравнения обнаружено увеличение количества тучных клеток, площади тучной клетки и индекса дегрануляции. Выявлена взаимосвязь между морфофункциональными параметрами тучных клеток и фиброзом миокарда.
Заключение. Обнаружено увеличение количества тучных клеток в 1,5 раза, их площади в 1,43 раза и индекса дегрануляции в 2 раза в миокарде пациентов с гипертонической нефропатией по сравнению с пациентами без данной патологии. Выявлена прямая корреляционная взаимосвязь между площадью фиброза миокарда левого желудочка и количеством тучных клеток, индексом дегрануляции тучных клеток и площадью тучной клетки.
Синдром Аарскога–Скотта относится к группе редких генетических (орфанных) болезней, характеризующихся преимущественным поражением длинных трубчатых и плоских костей черепа. Проявления синдрома многообразны, среди них наиболее часто встречаются умеренная задержка роста, пороки развития урогенитальной системы, задержка умственного развития, множественные аномалии лицевого черепа. Причиной синдрома Аарскога–Скотта являются мутации гена FGD1, расположенного в Х-хромосоме, что определяет высокий риск развития патологии у лиц мужского пола. Ген FGD1 кодирует одноименный белок, который функционирует как фактор обмена гуаниновых нуклеотидов и служит специфическим активатором ГТФазы CDC42. Через свой основной эффектор CDC42 FGD1 регулирует множество клеточных процессов, включая экспрессию генов, клеточную дифференцировку, поляризацию клеток, транспорт белков и организацию внутриклеточного цитоскелета. Цель обзора – представить данные об этиологии, патогенезе, разнообразии клинических проявлений синдрома, предполагаемых механизмах патогенеза. Наряду с этим освещены важные аспекты, связанные с этой редкой генетической болезнью.
Издательство
- Издательство
- РНЦХ
- Регион
- Россия, Москва
- Почтовый адрес
- 119435, Москва, ГСП-1, Абрикосовский пер., д.2
- Юр. адрес
- 119435, Москва, ГСП-1, Абрикосовский пер., д.2
- ФИО
- КОТЕНКО Константин Валентинович (Директор)
- E-mail адрес
- info@med.ru
- Контактный телефон
- +7 (749) 5708330
- Сайт
- https:/med.ru